
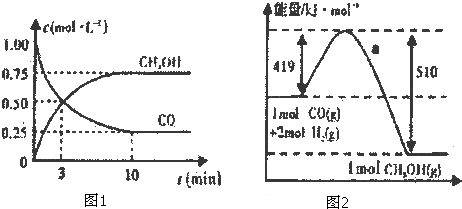
| n(CH3OH) |
| n(CO) |
| n(CH3OH) |
| n(CO) |
| △c |
| △t |
| 0.75mol |
| 10min |
 ,故答案為:
,故答案為: ;
;| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
| n(CH3OH) |
| n(CO) |


科目:高中化學 來源: 題型:
A、有機物B與 (M1=142.5)互為相鄰同系物,則M(B)可能為128.5 (M1=142.5)互為相鄰同系物,則M(B)可能為128.5 |
B、最簡單的醛糖是甘油醛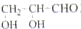 |
| C、苯和苯甲酸的混合物1mol,完全燃燒消耗O2的分子數為7.5NA |
| D、乙苯能被酸性KMnO4溶液氧化,是因為苯環對側鏈上的-CH2-產生了影響,使其變活潑 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、0.1 mol?L-1醋酸溶液中離子總數為0.2NA |
| B、T℃時,pH=6的純水中,含10-8NA個OH- |
| C、25℃時,1L pH=13的氫氧化鈉溶液中含有0.1NA氫氧根離子 |
| D、1L 0.1 mol?L-1的硫化鈉溶液中硫離子數目為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 時間 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、加入過量的Na2CO3溶液,過濾除去沉淀,所得溶液中補加適量稀HNO3 |
| B、加入過量的KCl溶液,過濾除去沉淀,所得溶液中補加適量稀HNO3 |
| C、加入過量的K2CO3溶液,過濾除去沉淀,所得溶液中補加適量稀HNO3 |
| D、加入過量的NaCl溶液,過濾除去沉淀,所得溶液中補加適量稀HNO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
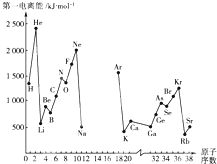 根據信息回答列問題:
根據信息回答列問題:| 元素符號 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 電負性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com