
 甲醇來源豐富、價格低廉、運輸貯存方便,是一種重要的化工原料,有著重要的用途和應用前景.工業生產甲醇的常用方法是CO(g)+2H2(g)═CH3OH(g)△H<0.
甲醇來源豐富、價格低廉、運輸貯存方便,是一種重要的化工原料,有著重要的用途和應用前景.工業生產甲醇的常用方法是CO(g)+2H2(g)═CH3OH(g)△H<0.分析 (1)依據燃燒熱概念是1mol可燃物完全燃燒生成穩定氧化物放出的熱量,題干所給量計算32g甲醇燃燒生成二氧化碳和液態水放熱,結合熱化學方程式書寫方法,標注物質聚集狀態和對應焓變;
(2)反應為CH3OH(g)?CO(g)+2H2(g),此反應能自發進行的原因是△H-T△S<0,反應是熵增加的反應;
(3)①根據圖知,交換膜是質子交換膜,則電解質溶液呈酸性,根據氫離子移動方向知,通入a的電極為負極、通入b的電極為正極,負極上甲醇失去電子發生氧化反應;
②負極反應式為CH3OH-6e-+H2O=CO2+6H+,正極反應式為O2+4H++4e-=2H2O,根據電解池的工作原理和電極方程式來計算.
解答 解:(1)在25℃、101kPa下,1g甲醇(CH3OH)燃燒生成CO2和液態水時放熱QkJ.32g甲醇燃燒生成二氧化碳和液態水放出熱量為32QKJ;則表示甲醇燃燒熱的熱化學方程式為:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-32QkJ•mol-1,
故答案為:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-32QkJ•mol-1;
(2)反應為CH3OH(g)?CO(g)+2H2(g),此反應能自發進行的原因是△H-T△S<0,反應是熵增加的反應,
故答案為:反應是熵增加的反應,△S>0;
(3)①根據圖知,交換膜是質子交換膜,則電解質溶液呈酸性,根據氫離子移動方向知,通入a的電極為負極、通入b的電極為正極,負極上甲醇失去電子發生氧化反應,負極反應式為 CH3OH-6e-+H2O=CO2+6H+,正極上氧氣得電子發生還原反應,電極反應式為O2+4e-+4H+=2H2O,
故答案為:負;CH3OH-6e-+H2O=CO2+6H+;
②負極反應式為CH3OH-6e-+H2O=CO2+6H+,當轉移2mol電子時,左側質量減輕$\frac{1}{6}$×2×(44-32)g=4g,還要有2molH+通過質子交換膜進入右側,質量減少2g,正極反應式為O2+4H++4e-=2H2O,右側質量增加32g×$\frac{1}{4}$×2=16g,加上轉移過來的2gH+,因此左右兩側溶液的質量之差為16g+2g+4g+2g=24g,
故答案為:24g;
點評 本題考查了反應熱的計算、蓋斯定律的應用,題目難度中等,注意掌握熱化學方程式的書寫原則,明確蓋斯定律在反應熱計算中的應用,試題培養了學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 我國目前使用的主要能源是煤、石油和天然氣 | |
| B. | 解決能源危機的方法是開發新能源和節約現有能源,提高能源的利用率 | |
| C. | 開發的新能源包括太陽能、氫能、核能等,它們都是可再生能源 | |
| D. | 提高燃料利用率的方式是科學控制反應,使燃料充分燃燒 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol溴苯中含有雙鍵的數目為0.3NA | |
| B. | 標準狀況下,22.4 L己烷中含己烷分子數目為NA | |
| C. | 1mol甲醇中含有C-H鍵的數目為4NA | |
| D. | 標準狀況下,11.2 L由CH4和C2H4組成的混合氣體中含有氫原子的數目為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,1.06gNa2CO3含有Na2CO3分子數為0.01NA個 | |
| B. | 標準狀況下,22.4LCCl4含有的分子數為1NA個 | |
| C. | 通常狀況下,NA個CO2分子占有的體積為22.4L | |
| D. | 0.5mol/L的MgCl2溶液和1mol/L的NaCl溶液中所含Cl-的物質的量濃度相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4Cl的電子式: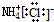 | |
| B. | 氯離子的結構示意圖: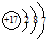 | |
| C. | 乙酸的結構簡式:CH3COOH | |
| D. | 硫酸的電離方程式:H2SO4=H++SO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com