
 ,故答案為:
,故答案為: ;
;
| ||
| ||
| ||
| △ |
| ||
| △ |
| 0.15mol |
| 0.45mol |
| c2(NH3) |
| c(N2)c3(H2) |
| 0.12 |
| 0.1×0.33 |


科目:高中化學 來源: 題型:
| A、非金屬單質燃燒時火焰均為無色 |
| B、焰色反應均應透過藍色鈷玻璃觀察 |
| C、NaCl與Na2CO3灼燒時火焰顏色相同 |
| D、所有金屬及其化合物灼燒時火焰均有顏色 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
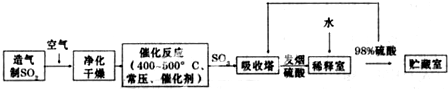
| 氧氣 |
| 熱空氣或 |
| 水蒸氣 |
| 堿液 |
| 吸收 |
| 酸化 |
| 蒸餾 |
| 煅燒 |
| 水 |
| 海水 |
| 過濾 |
| 灼燒 |
| 熔化 |
| 電解 |
| 放電 |
| 水 |
| 吸收 |
| 一定條件下 |
| 合成塔 |
| 過量氯氣 |
| 水冷 |
| 分離 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 實驗操作 | 預期現象與結論 |
| 現象: 結論: | |
查看答案和解析>>
科目:高中化學 來源: 題型:
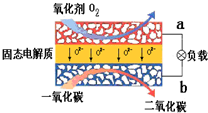 (1)有A、B、C、D四種金屬,已知:只有D投入水中可與水劇烈反應;用B和C作電極,稀硫酸作電解質溶液構成原電池時,C為正極;A和C的離子共存于電解液中,以石墨為電極電解時陰極析出A.則這四種金屬的活動性由強到弱的順序是
(1)有A、B、C、D四種金屬,已知:只有D投入水中可與水劇烈反應;用B和C作電極,稀硫酸作電解質溶液構成原電池時,C為正極;A和C的離子共存于電解液中,以石墨為電極電解時陰極析出A.則這四種金屬的活動性由強到弱的順序是查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com