
 常溫下,向20ml 0.1mol/L 酒石酸(用H2T表示)溶液中逐漸滴加等物質的量濃度的NaOH溶液.有關微粒的物質的量與混合溶液的pH有如圖關系,下列說法正確的是( )
常溫下,向20ml 0.1mol/L 酒石酸(用H2T表示)溶液中逐漸滴加等物質的量濃度的NaOH溶液.有關微粒的物質的量與混合溶液的pH有如圖關系,下列說法正確的是( )| A. | HT-在溶液中水解程度大于電離程度 | |
| B. | 當V(NaOH)=20mL時,溶液中水的電離程度比純水大 | |
| C. | 當V(NaOH)=30mL時,溶液中存在c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+) | |
| D. | 當V(NaOH)=40ml時,溶液中存在c(OH-)=c(HT-)+2 c(H2T)+c(H+) |
分析 A、根據圖示信息得到HT-在溶液中存在時的pH來回答;
B、20ml剛好中和一半,H+濃度比H2T少,溶液呈酸性,酸的電離程度大于弱離子的水解程度;
C、30ml溶液還呈酸性,溶液中[H+]>[OH-];
D、2mmol酒石酸需要40mlNaOH才能恰好中和,溶液中溶質為Na2T,依據質子守恒來回答.
解答 解:A、根據圖示信息得到HT-在溶液中存在時的pH<7,所以HT-在溶液中水解程度小于電離程度,故A錯誤;
B、VNaOH=20mL時,得到溶液中是等濃度的H2T和Na2T,圖象分析電離大于水解,溶液呈酸性,酸的電離程度大于弱離子的水解程度,所以溶液中水的電離程度比純水小,
故B錯誤;
C、VNaOH=30mL時,溶液中主要是H2T和Na2T,圖象分析溶液呈酸性,溶液中[H+]>[OH-],故C錯誤;
D、VNaOH=40mL時,和氫氧化鈉溶液恰好反應,溶液中溶質為Na2T,圖象分析可知溶液呈堿性,依據質子守恒溶液中存在[OH-]=[HT-]+2[H2T]+[H+],故D正確;
故選D.
點評 本題考查了圖象分析判斷,溶液酸堿性的過程理解是解題關鍵,題目難度較大.


科目:高中化學 來源: 題型:選擇題
| A. | 滴加石蕊試液顯紅色的溶液:Fe3+、NH4+、Cl-、CH3COO- | |
| B. | pH值為1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水電離出來的c(H+)=10-12mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶質為Na2CO3的溶液:K+、Ca2+、NO3-、Al3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
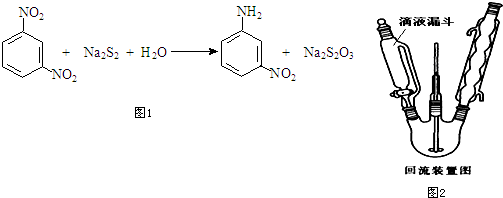
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 天然弱堿性水呈堿性的原因是其中含有較多的Mg2+、Ca2+等離子 | |
| B. | 蛋白質、淀粉和油脂都屬于高分子化合物,一定條件下都能水解 | |
| C. | 福爾馬林、葡萄糖溶液與新制氫氧化銅懸濁液共熱,都會有磚紅色沉淀產生 | |
| D. | 構成物質微粒的種類和數量不同、彼此的結合方式多樣,決定了物質的多樣性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
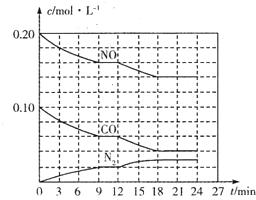 為有效控制霧霾,各地積極采取措施改善大氣質量.有效控制空氣中氮氧化物、碳氧化物和硫氧化物顯得尤為重要.
為有效控制霧霾,各地積極采取措施改善大氣質量.有效控制空氣中氮氧化物、碳氧化物和硫氧化物顯得尤為重要.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使甲基橙呈紅色的溶液:Na+、NH4+、AlO2-、CO32- | |
| B. | 8% H2O2溶液:H+、Fe2+、SO42-、Cl- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | 澄清透明的溶液中:Cu2+、Na+、NO3-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com