

分析 (1)“原子經濟”是指在化學品合成過程中,所用的所有原材料盡可能多的轉化到最終產物中,原子利用率為100%最經濟;
(2)已知:①2CH3OH(g)═CH3OCH3(g)+H2O(g)?△H1=-23.9kJ•mol-1
②2CH3OH(g)═C2H4 (g)+2H2O(g)?△H2=-29.1kJ•mol-1
③C2H5OH(g)═CH3OCH3(g))?△H3=+50.7kJ•mol-1
根據蓋斯定律,①-②-③可得:C2H4 (g)+H2O(g)═C2H5OH(g),則△H=△H1-△H2-△H3;
(3)①氫離子由質子交換膜由M電極區移向N電極區,則M為負極、N為正極,負極上發生氧化反應,甲醇失去電子,生成二氧化碳與氫離子,正極發生還原反應,氧氣獲得電子,與通過質子交換膜的氫離子結合為水;
②電解池溶液里Cr2O72-轉化為Cr3+,化合價降低共6價,左側Fe電極為陽極,Fe失去電子生成Fe2+,酸性條件Fe2+將Cr2O72-還原為Cr3+,自身被氧化為Fe3+,化合價升高共1價,化合價升降最小公倍數為6,則Cr2O72-的系數為1,Fe2+的系數為6,再結合電荷守恒、原子守恒配平方程式;
(4)Ksp=c(Cr3+)×c3(OH-)=6.4×10?31計算c(OH-),根據Kw=c(H+)×(OH-)計算溶液中c(H+),再根據pH=-lgc(H+)計算.
解答 解:①反應I中所用原材料原子均轉化到最終產物中,原子利用率為100%最經濟,反應Ⅰ符合“原子經濟”,故答案為:Ⅰ;
(2)已知:①2CH3OH(g)═CH3OCH3(g)+H2O(g)?△H1=-23.9kJ•mol-1
②2CH3OH(g)═C2H4 (g)+2H2O(g)?△H2=-29.1kJ•mol-1
③C2H5OH(g)═CH3OCH3(g))?△H3=+50.7kJ•mol-1
根據蓋斯定律,①-②-③可得:C2H4 (g)+H2O(g)═C2H5OH(g),則△H=△H1-△H2-△H3=-23.9kJ•mol-1-(-29.1kJ•mol-1)-50.7kJ•mol-1=-45.5kJ•mol-1,
故答案為:-45.5;
(3)①氫離子由質子交換膜由M電極區移向N電極區,則M為負極、N為正極,負極上發生氧化反應,甲醇失去電子,生成二氧化碳與氫離子,負極電極反應式為:CH3OH-6e-+H2O=6H++CO2↑,正極發生還原反應,氧氣獲得電子,與通過質子交換膜的氫離子結合為水,正極電極反應式為:O2+4e?+4H+=2H2O,
故答案為:正;CH3OH-6e-+H2O=6H++CO2↑;O2+4e?+4H+=2H2O;
②電解池溶液里Cr2O72-轉化為Cr3+,化合價降低共6價,左側Fe電極為陽極,Fe失去電子生成Fe2+,酸性條件Fe2+將Cr2O72-還原為Cr3+,自身被氧化為Fe3+,化合價升高共1價,化合價升降最小公倍數為6,則Cr2O72-的系數為1,Fe2+的系數為6,反應離子方程式為:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案為:1;6;14H+;2;6;7;
(4)Ksp=c(Cr3+)×c3(OH-)=6.4×10?31,c(Cr3+)=1×10?5mol•L-1 時,溶液中c(OH-)=4×10?9mol•L-1,則c(H+)=$\frac{1{0}^{-14}}{4×1{0}^{-9}}$mol/L=2.5×10?6mol•L-1,則pH=-lg2.5×10?6=5.6,
故答案為:5.6.
點評 本題考查反應熱計算、電解原理、氧化還原反應配平、溶度積有關計算等,(3)注意根據質子移動方向判斷電極,是對學生綜合能力的考查,難度中等.


科目:高中化學 來源: 題型:選擇題
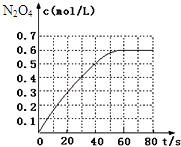 298K時,在2L固定體積的密閉容器中,發生可逆反應:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物質的量濃度隨時間變化如圖.達平衡時,N2O4的濃度為NO2的2倍,若反應在398K進行,某時刻測得n(NO2)=0.6mol、n(N2O4)=1.2mol,則此時,下列大小關系正確的是( )
298K時,在2L固定體積的密閉容器中,發生可逆反應:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物質的量濃度隨時間變化如圖.達平衡時,N2O4的濃度為NO2的2倍,若反應在398K進行,某時刻測得n(NO2)=0.6mol、n(N2O4)=1.2mol,則此時,下列大小關系正確的是( )| A. | v(正)>v(逆) | B. | v(正)<v(逆) | ||
| C. | v(正)=v(逆) | D. | v(正)、v(逆)大小關系不確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
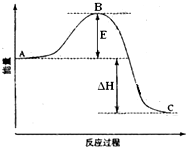 2SO2(g)+O2(g)═2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ•mol-1.請回答下列問題:
2SO2(g)+O2(g)═2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ•mol-1.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4LCl2完全反應轉移電子數一定為2×6.02×1023 | |
| B. | 因SO2具有漂白性,故可使品紅溶液、酸性KMnO4溶液褪色 | |
| C. | 常溫下,$\frac{c(OH-)}{c(H+)}$=10-10的溶液中:Na+、Al3+、SO42-、NO3-可大量共存 | |
| D. | 將20.0gNaOH固體置入500mL容量瓶,然后加水至刻度線即得1.00mol/L的NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
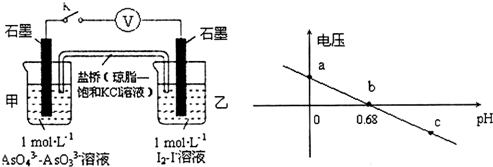
| A. | a點時,鹽橋中K+向左移動 | |
| B. | b點時,反應處于化學平衡狀態 | |
| C. | c點時,正極的電極反應為AsO43-+2H++2e-=AsO33-+H2O | |
| D. | pH>0.68時,氧化性I2>AsO43- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4種 | B. | 6種 | C. | 7種 | D. | 8種 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com