
 元素X的基態原子中的電子共有7個能級,且最外層電子數為1,X原子的內層軌道全部排滿電子.在氣體分析中,常用XCl的鹽酸溶液吸收并定量測定CO的含量,其化學反應如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O
元素X的基態原子中的電子共有7個能級,且最外層電子數為1,X原子的內層軌道全部排滿電子.在氣體分析中,常用XCl的鹽酸溶液吸收并定量測定CO的含量,其化學反應如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O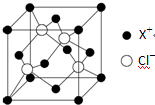
分析 (1)根據題目給出信息判斷出X為銅元素,結合構造原理寫出核外電子排布式;
(2)元素非金屬性越強,電負越強;
(3)①等電子體為原子數和價電子數分別相同的離子或原子團;
②根據氯原子形成的共價鍵和孤對電子數目判斷;
③表示配位鍵時,箭頭指向提供空軌道的原子或離子;
(4)根據晶胞結構和均攤法判斷離子數目以及化學式.
解答 解:(1)由于含有7個能級,根據能量最低原則,寫出7個能級為1s2s2p3s3p3d4s;且最外層電子數為1,X原子的內層軌道全部排滿電子,電子排布為1s22s22p63s23p63d104s1或[Ar]3d104s1,故答案為:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)元素非金屬性越強,電負越強,則C、H、O的電負性由大到小的順序是:O>C>H,
故答案為:O>C>H;
(3)①CO分子中含有2個原子、價電子數是10,與CO互為等電子體的陰離子微粒有CN-或C22-,陽離子為NO+,
故答案為:CN-或C22-;NO+;
②氯原子與X原子形成了1條配位鍵,1條共價鍵,另外存在2對孤對電子,即有4個雜化軌道,雜化類型為sp3,
故答案為:sp3;
③根據氯原子最外層電子數為7可知,氯原子可形成一對共用電子對,即氯原子形成的兩條共價鍵中只有一條為配位鍵,而X可形成三條配位鍵,可據此標出配位鍵,
故答案為: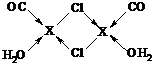 ;
;
(4)每個晶胞頂點的X+最近的Cl-有1個,在晶胞的體內,4個晶胞共用這個頂點,則X+最近的Cl-的個數為4個;每個晶胞中X+位于頂點和面上,則個數為:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每個晶胞中Cl-的在體內,個數為4個,則化學式為CuCl,故答案為:4;4;CuCl.
點評 本題是對物質結構與性質的考查,涉及核外電子排布、電負性大小比較、雜化方式與等電子體,注意對基礎知識的理解掌握,題目難度中等.


 活力試卷系列答案
活力試卷系列答案 課課優能力培優100分系列答案
課課優能力培優100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | 能使濕潤的酚酞試液變紅 | |
| B. | 能使濕潤的紅色石蕊試紙變藍 | |
| C. | 氨氣的水溶液呈中性 | |
| D. | 氣體與蘸有濃鹽酸的玻璃棒靠近產生大量白煙 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:1 | B. | 2:3 | C. | 3:1 | D. | 1:6 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某興趣小組要進行有關氫氣的定量測定實驗,為保證氫氣不損失,設計用甲、乙兩裝置及橡膠管完成鋅粒和稀硫酸制取氫氣的操作.步驟如下:
某興趣小組要進行有關氫氣的定量測定實驗,為保證氫氣不損失,設計用甲、乙兩裝置及橡膠管完成鋅粒和稀硫酸制取氫氣的操作.步驟如下:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(D)=1mol/(L•s) | B. | v(B)=1mol/(L•min) | C. | v(A)=0.5mol/(L•s) | D. | v(C)=0.8mol/(L•s) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向苦鹵(含K+、Mg2+、Br-等)中通入Cl2是為了提取溴 | |
| B. | 粗鹽(含Ca2+、Mg2+、SO42-、泥沙等雜質)可采用除雜和重結晶等過程提純 | |
| C. | 海帶提碘只涉及物理變化,海水提鎂涉及復分解反應 | |
| D. | 富集溴一般先用空氣和水蒸氣吹出單質溴,再用SO2將其還原吸收 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol NH3 分子 | B. | NH3和NH4+ 總共1 mol | ||
| C. | NH3•H2O 1 mol | D. | NH3•H2O、NH3、NH4+ 總共1 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | O2與O5 | |
| B. | 1H和2H | |
| C. | 淀粉和纖維素 | |
| D. | CH3-CH2-CH2-CH3與 CH3-CH (CH3)-CH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C3H5O | B. | C2H8N2 | C. | C2H8 | D. | C2H5N |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com