
 把由NaOH、AlCl3、MgCl2三種固體組成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的渾濁液中,逐滴加入0.50 mol/L鹽酸,加入鹽酸的體積(V)與沉淀質量(W)變化關系如圖所示:
把由NaOH、AlCl3、MgCl2三種固體組成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的渾濁液中,逐滴加入0.50 mol/L鹽酸,加入鹽酸的體積(V)與沉淀質量(W)變化關系如圖所示:分析 將由NaOH、AlCl3、MgCl2三種固體組成的混合物溶于足量水,充分反應后得到0.58g白色沉淀,向所得的濁液中加入鹽酸時,0-10mL時沒有沉淀生成,說明溶液中NaOH過量,則鋁離子完全轉化為偏鋁酸根離子,白色沉淀為Mg(OH)2,根據Mg元素守恒:n(MgCl2)=n[Mg(OH)2];
加入鹽酸10-20mL,鹽酸和偏鋁酸鈉反應生成氫氧化鋁沉淀,離子反應方程式為:H2O+AlO2-+H+=Al(OH)3↓,沉淀最大時,溶液中存在的溶質是氯化鈉,沉淀為Mg(OH)2、Al(OH)3,根據離子方程計算n[Al(OH)3],再根據Al元素守恒計算n(AlCl3);P點所加鹽酸用于中和原混合物中的NaOH,此時所加鹽酸物質的量:n(HCl)=n(NaOH),沉淀最大時,溶液中存在的溶質是氯化鈉,由Na+離子和Cl-離子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl),再根據m=nM計算各物質的質量;進而計算P點加入鹽酸的體積.
解答 解:將由NaOH、AlCl3、MgCl2三種固體組成的混合物溶于足量水,充分反應后得到0.58g白色沉淀,向所得的濁液中加入鹽酸時,0-10mL時沒有沉淀生成,說明溶液中NaOH過量,則鋁離子完全轉化為偏鋁酸根離子,白色沉淀為Mg(OH)2,加入鹽酸10-20mL,鹽酸和偏鋁酸鈉反應生成氫氧化鋁沉淀,離子反應方程式為:H2O+AlO2-+H+=Al(OH)3↓,沉淀最大時,溶液中存在的溶質是氯化鈉,沉淀為Mg(OH)2、Al(OH)3,加入20-PmL鹽酸,氫氧化鎂和氫氧化鋁都與鹽酸反應生成氯化鋁和氯化鎂,溶液中的溶質是氯化鋁、氯化鎂和氯化鈉,
(1)10-20mL時,發生反應:H2O+AlO2-+H+=Al(OH)3↓,消耗鹽酸體積為20mL-10mL=10mL=0.01L,故n[Al(OH)3]=n(H+)=0.01L×0.5mol/L=0.005mol,根據Al元素守恒:n(AlCl3)=n[Al(OH)3]=0.005mol,則m(AlCl3)=0.005mol×133.5g/mol=0.6675g;
根據Mg元素守恒:n(MgCl2)=n[Mg(OH)2]=$\frac{0.58g}{58g/mol}$=0.01mol;
P點所加鹽酸用于中和原混合物中的NaOH,此時所加鹽酸物質的量:n(HCl)=n(NaOH),沉淀最大時,溶液中存在的溶質是氯化鈉,由Na+離子和Cl-離子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.005mol×3+0.02L×0.5mol/L=0.045mol,則m(NaOH)=0.045mol×40g/mol=1.8g;
答:混合物中NaOH的質量為1.8g,AlCl3的質量為0.6675g;
(2)P點溶液中溶質為NaCl、MgCl2、AlCl3,加入鹽酸相當于恰好與原混合物中NaOH反應,二者恰好反應時:n(HCl)=n(NaOH)=0.045mol,則V(HCl)=$\frac{0.045mol}{0.5mol/L}$=0.09L=90mL,
答:P點時加入HCl的體積90mL.
點評 本題以化學反應圖象形式考查混合物計算,明確各解得發生的反應是關鍵,綜合考查學生分析、計算能力,注意利用守恒進行的解答,難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題

 .
. 2NH3
2NH3查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 燃煤時加入適量石灰石,可減少廢氣中SO2的含量 | |
| B. | 京津冀、長三角、珠三角霧霾的形成與煤的燃燒、化工廠大量排放含硫、含氮氧化物、顆粒物和汽車排放的尾氣等有關 | |
| C. | pH小于7.0的降雨通常稱為酸雨 | |
| D. | 使用潔凈能源、為汽車安裝尾氣轉化裝置、對硝酸廠排放的廢氣進行堿處理能有效控制氮氧化物對空氣的污染 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 構造原理 | B. | 泡利不相容原理 | C. | 洪特規則 | D. | 能量最低原理 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃硝酸應保存在棕色試劑瓶并置于陰涼處 | |
| B. | 氫氟酸不能裝在玻璃瓶,應裝在塑料瓶中 | |
| C. | NaOH溶液用帶磨口玻璃瓶塞的試劑瓶保存 | |
| D. | 常溫下濃硫酸和濃硝酸可以鐵制槽罐車運輸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
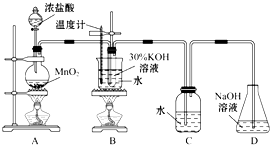 某化學興趣小組制取氯酸鉀和氯水并進行有關探究實驗.
某化學興趣小組制取氯酸鉀和氯水并進行有關探究實驗.| 試管編號 | 1 | 2 | 3 | 4 |
| 0.20mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸餾水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 實驗現象 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com