
| 滴定次數 | 待測液體積(mL) | 標準鹽酸體積(mL) | |
| 滴定前讀數(mL) | 滴定后讀數(mL) | ||
| 第一次 | 10.00 | 0.60 | 20.50 |
| 第二次 | 10.00 | 3.00 | 23.10 |
分析 (1)根據實驗操作的步驟以及每步操作需要儀器確定反應所需儀器來解答;
(2)根據堿性溶液盛放在堿式滴定管中;
(3)根據溶液顏色變化且半分鐘內不變色,可說明達到滴定終點;
(4)根據c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析不當操作對V(標準)的影響,以此判斷濃度的誤差;
(5)先分析所耗鹽酸標準液的體積的有效性,然后求出所耗鹽酸標準液的體積平均值,然后根據關系式HCl~NaOH來計算,再求出NaOH的質量和質量分數.
解答 解:(1)配制步驟有計算、稱量、溶解、冷卻、移液、洗滌、定容、搖勻等操作,一般用托盤天平稱量,用藥匙取用藥品,在燒杯中溶解(可用量筒量取),冷卻后轉移到250mL容量瓶中,并用玻璃棒引流,當加水至液面距離刻度線1~2cm時,改用膠頭滴管滴加,所以試驗除了需要250mL容量瓶、量筒、燒杯、膠頭滴管外,還有一種必須使用的儀器是玻璃棒;
故答案為:玻璃棒;
(2)燒堿顯堿性,故需要用堿式滴定管量取燒堿溶液;
故答案為:堿;
(3)滴定前溶液為紅色,滴定終點時溶液為無色,所以滴定終點現象為滴最后一滴溶液由紅色變為無色,半分鐘不褪色;
故答案為:當滴入最后一滴鹽酸,溶液由紅色變為無色,且半分鐘內不褪色;
(4)A.滴定前平視,滴定后俯視,造成V(標準)偏小,根據c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析,可知c(待測)偏小,燒堿純度偏小,故A不選;
B.未用標準液潤洗滴定管,標準液濃度減小,造成V(標準)偏大,根據c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析,可知c(待測)偏大,燒堿純度偏大,故B選;
C.用待測液潤洗錐形瓶,待測液的物質的量偏大,造成V(標準)偏大,根據c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析,可知c(待測)偏大,燒堿純度偏大,故C選確;
D.不小心將標準液滴在錐形瓶外面,造成V(標準)偏大,根據c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析,可知c(待測)偏大,燒堿純度偏大,故D選;
E.滴定接近終點時,用少量蒸餾水沖洗錐形瓶內壁,操作正確,不產生誤差,故E不選;
F.滴定前尖嘴有氣泡,滴定后消失,則標準溶液的體積偏大,根據c(待測)=$\frac{V(標準)×c(標準)}{V(待測)}$分析,可知c(待測)偏大,燒堿純度偏大,故F選;
故答案為:BCDF;
(5)所耗鹽酸標準液的體積分別為:19.90mL,20.10mL,兩組數據均有效,鹽酸標準液的平均體積為20.00mL;
HCl~~~~~~~NaOH
1 1
0.2000mol/L×20.00mL C(NaOH)×10mL
解得:c(NaOH)=0.4mol/L,則500mL的溶液中含有NaOH的質量為:0.4mol/L×0.50L×40g/mol=8.0g,燒堿樣品的純度為$\frac{8.0g}{8.8g}$×100%=91%;
故答案為:91.
點評 本題考查了物質含量的測定,主要考查了溶液的配制、酸堿中和滴定的操作、數據處理和物質含量的計算等,題目難度中等,掌握中和滴定的原理是解題的關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 乙烷光照下能與濃鹽酸發生取代反應 | |
| B. | 乙烯可以用作生產食品包裝材料的原料 | |
| C. | 乙醇室溫下在水中的溶解度大于溴乙烷 | |
| D. | 乙酸和甲酸甲酯互為同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
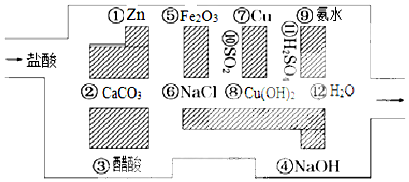
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某研究性學習小組的學生用標準濃度的氫氧化鈉溶液測定未知濃度的鹽酸溶液.
某研究性學習小組的學生用標準濃度的氫氧化鈉溶液測定未知濃度的鹽酸溶液.| 序號 | 選用指示劑 | 選用滴定管 |
| A | 石蕊 | (乙) |
| B | 甲基橙 | (甲) |
| C | 酚酞 | (甲) |
| D | 酚酞 | (乙) |
| 試驗編號 | 待測鹽酸溶液體積(mL) | 滴定開始讀數(mL) | 滴定結束讀數(mL) |
| ① | 25.00 | 0.00 | 20.00 |
| ② | 25.00 | 1.10 | 21.30 |
| ③ | 25.00 | 0.20 | 20.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數 | 待測液體積(mL) | 標準鹽酸體積(mL) | |
| 滴定前讀數(mL) | 滴定后讀數(mL) | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 用已知濃度的NaOH溶液測定某H2SO4溶液的濃度,參考如圖,從下表中選出
用已知濃度的NaOH溶液測定某H2SO4溶液的濃度,參考如圖,從下表中選出| 錐形瓶中的液 | 滴定管中的溶液 | 選用指示劑 | 選用滴定管 | |
| ① | 堿 | 酸 | 石蕊 | (乙) |
| ② | 酸 | 堿 | 酚酞 | (甲) |
| ③ | 堿 | 酸 | 酚酞 | (甲) |
| ④ | 酸 | 堿 | 酚酞 | (乙) |
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數 實驗數據 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH)/mL(初讀數) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH)/mL(終讀數) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 少量的氯水加入到盛有NaBr溶液的試管中 | |
| B. | 取一小片鋁,砂紙除去氧化膜,放入試管中,加入少量2mL水 | |
| C. | 將鋅片與銅片用導線連接,插入盛稀硫酸的燒杯中 | |
| D. | 向盛有過氧化氫水溶液的試管中,加入少量1mol/LFeCl3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
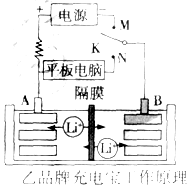 充電寶基本都由聚合物鋰電池作為儲電單元,它本身就是一個聚合物鋰電池的儲電裝置,通過IC芯片進行電壓的調控,再通過連接電源線充電或儲電后將貯存的電量釋放出來.
充電寶基本都由聚合物鋰電池作為儲電單元,它本身就是一個聚合物鋰電池的儲電裝置,通過IC芯片進行電壓的調控,再通過連接電源線充電或儲電后將貯存的電量釋放出來.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com