
【題目】碘及其化合物在合成殺菌劑、藥物等方面具有廣泛用途。回答下列問題:
(1)大量的碘富集在海藻中,用水浸取后濃縮,再向濃縮液中加MnO2和H2SO4,即可得到I2,該反應的還原產物為___________;
(2)上述濃縮液中含有I-、Cl-等離子,取一定量的濃縮液,向其中滴加AgNO3溶液,當AgCl開始沉淀時,溶液中![]() 為:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
為:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反應2HI(g)![]() H2(g)+I2(g)的△H=+11kJmol-1,1molH2(g)、1molI2(g)分子中化學鍵斷裂時分別需要吸收436kJ、151kJ的能量,則1molHI(g)分子中化學鍵斷裂時需吸收的能量為___________ kJ。
H2(g)+I2(g)的△H=+11kJmol-1,1molH2(g)、1molI2(g)分子中化學鍵斷裂時分別需要吸收436kJ、151kJ的能量,則1molHI(g)分子中化學鍵斷裂時需吸收的能量為___________ kJ。
(4)Bodensteins研究了下列反應:2HI(g)![]() H2(g)+I2(g),在716K時,氣體混合物中碘化氫的物質的量分數x(HI)與反應時間t的關系如表:
H2(g)+I2(g),在716K時,氣體混合物中碘化氫的物質的量分數x(HI)與反應時間t的關系如表:
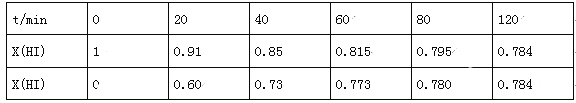
①根據上述實驗結果,該反應的平衡常數K的計算式為:___________;
②上述反應中,正反應速率為v正=k正x2(HI),逆反應速率為v逆=k逆x(H2)x(I2),其中k正、k逆為速率常數,則k逆為___________(以K和k正表示).若k正=0.0027min-1,在t=40min時,v正=___________min-1.
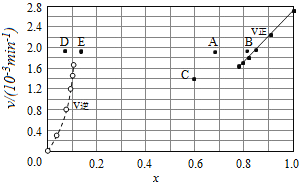
③由上述實驗數據計算得到v正~x(HI)和v逆~x(H2)的關系可用如圖表示.當升高到某一溫度時,反應重新達到平衡,相應的點分別為___________(填字母).
【答案】
(1)MnSO4;
(2)4.7×10-7;
(3)299kJ;
(4)①![]() ;②
;②![]() ;1.95×10-3;③A;E
;1.95×10-3;③A;E
【解析】
試題分析:(1)海藻中的碘元素以碘化物形式存在,反應中I元素發生氧化反應,Mn元素被還原,還原產物應為硫酸錳,故答案為:MnSO4;
(2)當AgCl開始沉淀時,說明溶液中的c(I-)和c(Cl-)均已達到飽和狀態,因此可以根據溶度積表達式進行計算,溶液中![]() =
=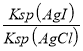 =
=![]() =4.7×10-7,故答案為:4.7×10-7;
=4.7×10-7,故答案為:4.7×10-7;
(3)設1molHI(g)分子中化學鍵斷裂時需吸收的能量為x kJ,則:2x kJ-436kJ-151kJ=11kJ,解得x=299,故答案為:299kJ;
(4)①表中第一列,由HI分解建立平衡,表中第二列向逆反應進行建立平衡,由第一列數據可知,平衡時HI物質的量分數為0.784,則氫氣、碘蒸汽總物質的量分數為1-0.784=0.216,而氫氣、與碘蒸汽物質的量分數相等均為0.108,反應前后氣體體積不變,用物質的量分數代替濃度計算平衡常數,則平衡常數K=![]() =
=![]() ,故答案為:
,故答案為:![]() ;
;
②到達平衡時,正、逆反應速率相等,則k正x2(HI)=k逆x(H2)x(I2),則k逆=k正×![]() =
=![]() ,
,
在t=40min時,正反應建立平衡的x(HI)=0.85,則v正=k正x2(HI)=0.0027min-1×0.852=1.95×10-3min-1,故答案為:![]() ;1.95×10-3;
;1.95×10-3;
③對于2HI(g)![]() H2(g)+I2(g)反應建立平衡時:升高溫度,正、逆反應速率均加快,因此排除C點,正反應為吸熱反應,升高溫度,平衡向吸熱反應方向移動,因此平衡正向移動,再次平衡時HI的物質的量分數減小,因此排除B點,故選A點;對于H2(g)+I2(g)
H2(g)+I2(g)反應建立平衡時:升高溫度,正、逆反應速率均加快,因此排除C點,正反應為吸熱反應,升高溫度,平衡向吸熱反應方向移動,因此平衡正向移動,再次平衡時HI的物質的量分數減小,因此排除B點,故選A點;對于H2(g)+I2(g)![]() 2HI(g)反應建立平衡時:升高溫度,正、逆反應速率均加快,升高溫度,平衡向吸熱反應方向移動,因此平衡逆向移動,再次平衡時H2的物質的量分數增大,故選E點;因此反應重新達到平衡,v正~x(HI)對應的點為A,v逆~x(H2)對應的點為E,故答案為:A;E。
2HI(g)反應建立平衡時:升高溫度,正、逆反應速率均加快,升高溫度,平衡向吸熱反應方向移動,因此平衡逆向移動,再次平衡時H2的物質的量分數增大,故選E點;因此反應重新達到平衡,v正~x(HI)對應的點為A,v逆~x(H2)對應的點為E,故答案為:A;E。


 好成績1加1期末沖刺100分系列答案
好成績1加1期末沖刺100分系列答案 金狀元績優好卷系列答案
金狀元績優好卷系列答案科目:高中化學 來源: 題型:
【題目】根據化學反應中的能量變化關系回答下列問題:
(1)斷開1molH-H鍵,1molN-H鍵,1molN≡N鍵分別需要吸收的能量為436kJ、391kJ、946kJ,求:
①1molN2生成NH3需______(填“吸收”或“放出”)能量______kJ;
②1molH2生成NH3需______(填“吸收”或“放出”)能量______kJ。
(2)航天飛船可用肼(N2H4)作動力源。已知1mol液態肼和足量的液態過氧化氫反應生成氮氣和水蒸氣時放出641.6kJ熱量,化學方程式如下:N2H4+2H2O2===N2↑+4H2O。
①該反應中肼作 (填氧化或還原)劑;
②該反應的反應物總能量 (填高于或低于)生成物的總能量;
③此情況下,液態肼燃燒生成0.5molN2時放出的熱量為 kJ;
④肼(N2H4)分子中存在的化學鍵有 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇(CH3OH)是一種可再生能源,具有廣泛的開發和應用前景。
(1)已知在常溫常壓下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
請計算1 mol甲醇不完全燃燒生成1 mol一氧化碳和液態水放出的熱量為________
(2)某實驗小組依據甲醇燃燒的反應原理,設計如右圖所示的電池裝置。
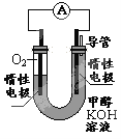
①工作一段時間后,測得溶液的pH 。(填“增大”“減小”“不變”)
②該電池負極的電極反應為 。
(3)某金屬的相對原子質量為52.00,用上述電池電解該金屬的一種含氧酸鹽的酸性水溶液時,陽極每放出3 360 mL(標準狀況)氧氣,陰極析出金屬10.4 g,在該含氧酸鹽中金屬的化合價為 ,
在該實驗中,若不考慮能量的損失,電池中消耗甲醇的質量最少是 g(結果精確至0.1 g)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵酸鉀(K2FeO4)是一種集氧化、吸附、絮凝于一體的新型多功能水處理劑。其生產工藝如下:
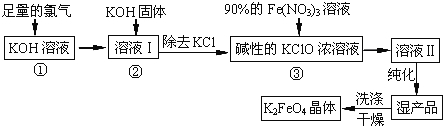
(1)反應①應在溫度較低的情況下進行.因在溫度較高時KOH 與Cl2 反應生成的是KClO3.寫出在溫度較高時KOH 與Cl2反應的化學方程式 ;
(2)在反應液I中加入KOH固體的目的是 (填編號);
A.與反應液I中過量的Cl2繼續反應,生成更多的KClO
B.KOH固體溶解時會放出較多的熱量,有利于提高反應速率
C.為下一步反應提供堿性的環境
D.使KClO3轉化為 KClO
(3)從溶液II中分離出K2FeO4后,還會有副產品KNO3、KCl,則反應③中發生的離子反應方程式為 。
(4)如何判斷K2FeO4晶體已經洗滌干凈 。
(5)高鐵酸鉀(K2FeO4)作為水處理劑的一個優點是能與水反應生成膠體吸附雜質,其離子反應是: FeO42﹣+ H2O= Fe(OH)3(膠體)+ O2↑+
完成并配平上述反應的離子方程式。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Cu2S 可用于制防污涂料,其可由熱的銅在硫蒸氣或H2S 中反應制得。
(1)銅元素在元素周期表中的位置為 ____________,Cu+的核外電子排布式為_________,基態銅原子核外電子共有__________種運動狀態。
(2)Cu2S在一定條件下可被氧化為CuSO4。
①在SO42—中S原子的雜化軌道類型為________;SiO44—、PO43—與 SO42—互為________;其中Si、P、S第一電離能由大到小順序為________________ ;
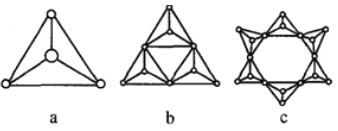
②硅酸鹽與二氧化硅一樣,都是以硅氧四面體作為基本結構單元,硅氧四面體可以用圖a 表示,圖中b、c 是硅氧四面體結合成環狀結構的兩個例子,若在環狀結構中硅的原子數為n,寫出環狀結構中硅酸根離子的通式_______________。
(3)甲醇(CH3OH)中的羥基被硫羥基取代生成甲硫醇(CH3SH),二者部分物理性質如下:
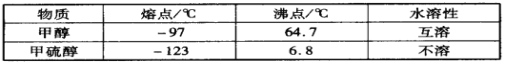
甲醇和甲硫醇在熔沸點和水溶性方面性質差異的原因是__________________________。
(4)某化合物由S、Fe、Cu 三種元素組成,其晶胞結構如下圖所示(1 pm=10-10cm),該晶胞上下底面為正方形,側面與底面垂直,則該晶體的密度ρ=_________g/cm3(保留三位有效數字)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由環己烷可制得1,4-環己二醇,流程如下(其中無機產物都已略去),試回答:

(1)反應_________屬于取代反應(填反應序號).
(2)化合物的結構簡式:B______________,C_______________.
(3)反應⑥所用試劑和條件是________________________.
(4)寫出反應②、⑤的化學方程式:反應②________________反應⑤__________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W、R是短周期元素,原子序數依次增大。X原子核外各層電子數之比為1:2,Y原子和Z原子的核外電子數之和為20,W和R是同周期相鄰元素,Y的氧化物和R的氧化物均能形成酸雨。
請回答下列問題:
(1)元素X的最高價氧化物的電子式為 ;元素Z的離子結構示意圖為 。
(2)單質X和元素Y的最高價氧化物對應水化物的濃溶液發生反應的化學方程式為 。Y、W的氫化物沸點高的是 (寫化學式),原因是 。
(3)元素W位于周期表的第 族, 其非金屬性比元素R弱,用原子結構的知識解釋原因 。
(4) Y和Z組成的化合物ZY,被大量用于制造電子元件。工業上用Z的氧化物、X單質和Y單質在高溫下制備ZY,其中Z的氧化物和X單質的物質的量之比為1:3,則該反應的化學方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某人設計淀粉利用方案如圖所示。其中:A能催熟水果,B是高分子化合物,D是有水果香味的物質。請回答以下問題:
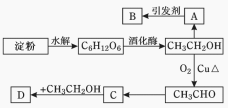
(1)C6H12O6的名稱是________,A的電子式為_________,C中含有官能團名稱 ;
(2)A→B反應類型____________;C→D反應類型____________。
(3)寫出下列轉化的化學方程式:
① A→B:______________________________________________________;
② A→CH3CH2OH:______________________________________;
③ C→D:_____________________________________________________;
④ CH3CH2OH→CH3CHO:_____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】尿素[CO(NH2)2]是首個由無機物人工合成的有機物
(1)工業上尿素由CO2和NH3合成,寫出其方程式 ___________________________.
(2)當氨碳比![]() 時,CO2的轉化率隨時間的變化關系如圖所示。
時,CO2的轉化率隨時間的變化關系如圖所示。

①A點的逆反應速率v逆(CO2)________B點的正反應速率v正(CO2)(填“大于”“小于”或“等于”)。
②NH3的平衡轉化率為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com