


 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:
| A、盛放氫氧化鈉溶液的試劑瓶不能用玻璃塞 |
| B、氯氣,濃氯和氯水是同一種物質 |
| C、從海水中提取溴,一般要經歷濃縮,氧化和提取三個步驟,氧化劑一般選擇氯氣 |
| D、向盛有碘水的試管中加入適量CCl4,振蕩靜置,溶液分層,上層無色下層紫紅色 |
查看答案和解析>>
科目:高中化學 來源: 題型:


查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
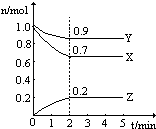 溫度一定,在一個10L的密閉容器中,X、Y、Z三種物質的物質的量隨時間的變化曲線如圖所示.試根據圖中數據,填寫下列空白:
溫度一定,在一個10L的密閉容器中,X、Y、Z三種物質的物質的量隨時間的變化曲線如圖所示.試根據圖中數據,填寫下列空白:查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A | ||
| B | C |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 編號 | 實驗操作 | 預期現象和結論 |
| 步驟① | 取少量待測液于試管A中,滴加2mol?L-1HCl至溶液呈酸性,加入幾滴 | 證明待測液中含SO32-. |
| 步驟② | 有白色沉淀生成, 證明待測液中含SO42-. | |
| 步驟③ | 另取少量待測液于試管C中,加入足量氯水,再加入四氯化碳,振蕩,靜置后觀察顏色. |
查看答案和解析>>
科目:高中化學 來源: 題型:
A、Al2(SO4)3=Al3++S
| ||
B、H2SO2═2H++S
| ||
| C、Ba(OH)2=Ba2++(OH-)2 | ||
D、KOH=K++
|
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com