
| A. | ①④⑤⑦ | B. | ①④⑦ | C. | ①③④⑤⑥ | D. | ②③⑤⑥ |
分析 ①求出白磷的物質的量,然后根據1mol白磷中含6molP-P鍵來分析;
②電解精煉銅時,陽極放電的不止是銅;
③Na2S和Na2O2均由2個鈉離子和1個陰離子構成;
④CO(g)的燃燒熱是283.0kJ/mol,即1molCO完全燃燒生成二氧化碳氣體時放出的熱量為283KJ;
⑤求出2CaSO4•H2O的物質的量,然后根據1mol2CaSO4•H2O中含1mol水分子來分析;
⑥銅只能與濃硫酸反應,和稀硫酸不反應;
⑦由于CO32-的水解,會導致陰離子個數增多.
解答 解:①12.4g白磷的物質的量為n=$\frac{12.4g}{124g/mol}$=0.1mol,而1mol白磷中含6molP-P鍵,故0.1mol白磷中含0.6molP-P鍵即0.6NA條,故①正確;
②電解精煉銅時,陽極放電的不止是銅,還有比銅活潑的雜質,故當轉移了NA個電子時,陽極上溶解的銅的質量小于32g,故②錯誤;
③Na2S和Na2O2的摩爾質量均為78g/mol,故7.8g混合物的物質的量為0.1mol,而兩者均由2個鈉離子和1個陰離子構成,故0.1mol混合物中含有的陰離子個數為0.1NA個,故③錯誤;
④CO(g)的燃燒熱是283.0kJ/mol,即1molCO完全燃燒生成二氧化碳氣體時放出的熱量為283KJ,故有:2CO(g)+O2(g)?2CO2(g)△H=-2×283.0kJ/mol,故2CO2(g)?2CO(g)+O2(g)△H=+2×283.0kJ/mol,故④正確;
⑤2.9g 2CaSO4•H2O的物質的量為n=$\frac{2.9g}{290g/mol}$=0.01mol,而1mol2CaSO4•H2O中含1mol水分子,故0.01mol 2CaSO4•H2O中含0.01mol水即0.01NA個水分子,故⑤錯誤;
⑥銅只能與濃硫酸反應,和稀硫酸不反應,故濃硫酸不能反應完全,故生成的二氧化硫分子個數小于0.1NA個,故⑥錯誤;
⑦由于CO32-的水解,會導致陰離子個數增多,即多于0.1NA個,故⑦正確.
故選B.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的使用和物質的結構是解題關鍵,難度不大.


 金鑰匙試卷系列答案
金鑰匙試卷系列答案科目:高中化學 來源: 題型:選擇題
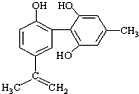 體育競技中服用興奮劑既有失公平,也敗壞了體育道德.某種興奮劑的結構簡式如圖所示.有關該物質的說法中,正確的是( )
體育競技中服用興奮劑既有失公平,也敗壞了體育道德.某種興奮劑的結構簡式如圖所示.有關該物質的說法中,正確的是( )| A. | 1mol該物質分別與濃溴水和H2反應時最多消耗和分別為4mol和7mol | |
| B. | 滴入酸性高錳酸鉀溶液振蕩,紫色褪去,能證明其結構中存在碳碳雙鍵 | |
| C. | 該物質與苯酚屬于同系物,遇溶液呈紫色 | |
| D. | 該分子中的所有碳原子不可能共平面 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
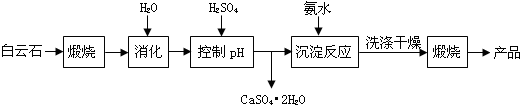
| 溫度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 顏色 | 黃色 | 綠色 | 藍色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲酸甲酯的結構簡式:CH2O | |
| B. | Na+的.結構示意圖: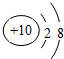 | |
| C. | 質子數為53、中子數為78的碘原子:${\;}_{53}^{131}$I | |
| D. | CO2的電子式為: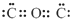 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 溶質 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同溫度下,同濃度的三種酸溶液的導電能力順序:H2CO3<HClO<HF | |
| B. | 若將0.2 mol•L-1Na2CO3和0.1 mol•L-1NaHCO3溶液等體積混合,則溶液中:3c(OHˉ)=3c(H+)+2c(HCO3ˉ)+5c(H2CO3)+c(CO32ˉ) | |
| C. | 根據上表,反應ClOˉ+H2O?HClO+OHˉ的水解常數Kh≈10ˉ7.6 | |
| D. | 向上述NaClO 溶液中通HF氣體至恰好完全反應時:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
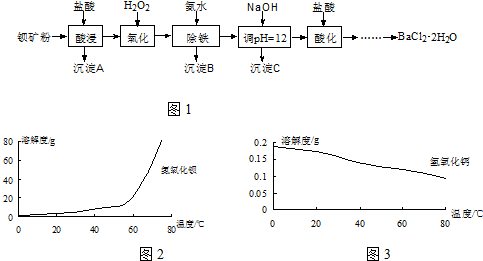
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com