
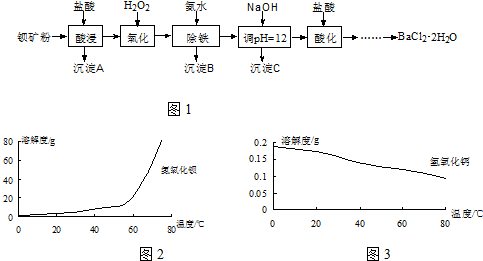
分析 鋇礦粉的主要成分BaCO3(含有Ca2+、Fe2+、Fe3+、Mg2+等),加鹽酸溶解,碳酸鋇和鹽酸反應:BaCO3+2H+=Ba2++CO2↑+H2O,過濾除去不溶物,濾液中加入H2O2將Fe2+氧化為Fe3+,再加入氨水調節溶液pH,使Fe3+轉化為Fe(OH)3沉淀過濾除去,溶液中主要含Ca2+、Mg2+、Ba2+,加入氫氧化鈉調節pH=12,使溶液中Mg2+轉化為Mg(OH)2沉淀、大部分Ca2+轉化為Ca(OH)2,過濾分離,濾液中加入鹽酸酸化,再通過蒸發濃縮、冷卻結晶、過濾等操作得到BaCl2•2H2O晶體.
(1)氧化過程是加入H2O2將Fe2+氧化為Fe3+;
(2)沉淀C的主要成分是氫氧化鈣與氫氧化鎂,由氫氧化鋇與氫氧化鈣的溶解度曲線可知,升高溫度氫氧化鋇溶解度增大,可以降低氫氧化鈣的溶解度;
(3)①步驟3:利用硫酸檢驗上清液是否含有Ba2+,確定沉淀完全;
②稱取試樣過少,沉淀量就少,洗滌造成的損失就大;
③步驟5:在坩堝中進而固體物質的灼燒;BaSO4被殘留的炭還原生成BaS,C被氧化生成CO或二氧化碳;
④由溶度積常數可知,兩種沉淀劑效果相差不大,用K2CrO4代替H2SO4作沉淀劑得到沉淀質量更大,測定誤差小.
解答 解:鋇礦粉的主要成分BaCO3(含有Ca2+、Fe2+、Fe3+、Mg2+等),加鹽酸溶解,碳酸鋇和鹽酸反應:BaCO3+2H+=Ba2++CO2↑+H2O,過濾除去不溶物,濾液中加入H2O2將Fe2+氧化為Fe3+,再加入氨水調節溶液pH,使Fe3+轉化為Fe(OH)3沉淀過濾除去,溶液中主要含Ca2+、Mg2+、Ba2+,加入氫氧化鈉調節pH=12,使溶液中Mg2+轉化為Mg(OH)2沉淀、大部分Ca2+轉化為Ca(OH)2,過濾分離,濾液中加入鹽酸酸化,再通過蒸發濃縮、冷卻結晶、過濾等操作得到BaCl2•2H2O晶體.
(1)氧化過程是加入H2O2將Fe2+氧化為Fe3+,以便調節溶液pH使鐵離子完全沉淀,反應的離子方程式為:H2O2+2Fe2++2H+=2Fe3++2H2O;
故答案為:H2O2+2Fe2++2H+=2Fe3++2H2O;
(2)加入氫氧化鈉調節pH=12,使溶液中Mg2+轉化為Mg(OH)2沉淀、大部分Ca2+轉化為Ca(OH)2,氫氧化鈣溶解度隨溫度升高減小,為了更好的使Ca2+沉淀,還應采取的措施為提高溫度;
故答案為:Mg(OH)2;提高溫度;
(3)①步驟3所缺的操作是檢驗Ba2+是否沉淀完全,具體操作為:向上層清液中加入1~2滴0.1mol/LH2SO4溶液,
故答案為:向上層清液中加入1~2滴0.1mol/LH2SO4溶液;
②若步驟1稱量的樣品過少,則在步驟4洗滌時可能造成的影響為:沉淀量就少,洗滌造成的損失就大;
故答案為:稱取試樣過少,沉淀量就少,洗滌造成的損失就大;
③將折疊的沉淀濾紙包置于坩堝中經烘干、炭化、灰化后在800℃灼燒至恒重,稱量計算BaCl2•2H2O中Ba2+的含量;濾紙灰化時空氣要充足,否則BaSO4易被殘留的炭還原生成BaS,C被氧化生成CO或二氧化碳,反應的化學方程式為:BaSO4+4C$\frac{\underline{\;高溫\;}}{\;}$4CO↑+BaS或BaSO4+2C$\frac{\underline{\;高溫\;}}{\;}$2CO2↑+BaS,
故答案為:坩堝;BaSO4+4C$\frac{\underline{\;高溫\;}}{\;}$4CO↑+BaS或BaSO4+2C$\frac{\underline{\;高溫\;}}{\;}$2CO2↑+BaS;
④由溶度積常數可知,兩種沉淀劑效果相差不大,由于BaCrO4的摩爾質量大于BaSO4 ,用K2CrO4代替H2SO4作沉淀劑得到沉淀質量更大,測定誤差小;
故答案為:BaCrO4的摩爾質量大于BaSO4 ,得到沉淀質量更大,測定誤差小.
點評 本題考查物質制備、物質含量測定等,側重對原理與操作考查,熟練掌握元素化合物知識,(3)中④為易錯點、難點,定量實驗中要強調減少誤差的意識,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑤⑦ | B. | ①④⑦ | C. | ①③④⑤⑥ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用蘸有濃氨水的棉棒檢驗輸送氯氣的管道是否漏氣 | |
| B. | 用合成聚碳酸酯可降解塑料,實現“碳”的循環利用 | |
| C. | 大力實施礦物燃料脫硫脫硝技術,能減少二氧化硫、氮氧化物的排放 | |
| D. | 向工業生產的反應中加入合適的催化劑,能改變反應的焓變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯、乙醇和乙酸都能發生取代反應 | |
| B. | 等物質的量的乙醇和乙酸完全燃燒時所需氧氣的質量相等 | |
| C. | 乙醇、乙酸和乙酸乙酯能用飽和NaHCO3溶液鑒別 | |
| D. | 乙烷和丙烯的物質的量各1mol,完成燃燒生成3molH2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3種 | B. | 4種 | C. | 5種 | D. | 6種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com