
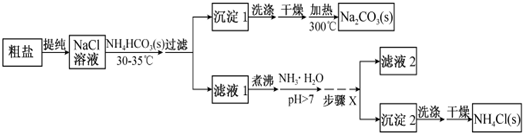
分析 根據題中流程可知,粗鹽水提純后得氯化鈉溶液,經蒸發濃縮后,溫度控制在30℃~35℃,防止碳酸氫按分解,加入碳酸氫銨,生成沉淀1為碳酸氫鈉,濾液1主要為氯化銨,氯化銨溶液中加入氨水,可抑制銨根離子的水解,經過蒸發濃縮、冷卻結晶、過濾可得沉淀2為氯化銨固體,經洗滌、干燥得純凈的氯化銨,濾液2中含有少量的氯化銨和碳酸氫鈉,
(1)蒸發濃縮時溶液要加熱,而NH4HCO3在36℃開始分解,據此答題;
(2)氨水能抑制銨根離子的水解,同時能使NaHCO3轉化為Na2CO3,并補充煮沸時損失的NH3,從氯化銨溶液得到氯化銨固體可以通過蒸發濃縮,冷卻結晶,過濾的方法;
(3)①滴定操作過程中,滴定前,滴定管必須檢漏和潤洗,而錐形瓶只能水洗,滴定時堿溶液只能盛裝在堿式滴定管里,并且滴定管尖嘴上懸掛的液滴要除掉,否則會影響滴定結果,調整液面時每次均需調至“0”刻度或“0”刻度以下的附近位置;
②用來標定NaOH標準溶液的鄰苯二甲酸氫鉀基準物使用前未烘至恒重,則標定NaOH標準溶液的濃度偏高,再用NaOH標準溶液滴定時,雖消耗的標準液體積不變,但仍導致NH4Cl產品的含量產生誤差.
解答 解:(1)蒸發濃縮時溶液要加熱,而NH4HCO3在36℃開始分解,所以在加入固體NH4HCO3之前進行蒸發濃縮優于在加入NH4HCO3之后,原因是可避免NH4HCO3的分解,故答案為:可避免NH4HCO3的分解;
(2)氨水能抑制銨根離子的水解,同時能使NaHCO3轉化為Na2CO3,并補充煮沸時損失的NH3,從氯化銨溶液得到氯化銨固體可以通過蒸發濃縮,冷卻結晶,過濾的方法,
故答案為:抑制NH4+水解、使NaHCO3轉化為Na2CO3、補充煮沸時損失的NH3;蒸發濃縮、冷卻結晶、過濾;
(3)①A.為了減少滴定誤差,滴定管須用待裝液潤洗,錐形瓶不必潤洗,A錯誤;
B.因其腐蝕性強,標準NaOH溶液裝入堿式滴定管或帶有耐腐蝕旋塞的玻璃滴定管中,B正確;
C.開始滴定前,滴定管尖懸掛的液滴需除掉,C錯誤;
D.測定時,每次需將滴定管中的液面調至“0”刻度或“0”刻度以下的附近位置,D正確;
故答案為:BD;
②鄰苯二甲酸氫鉀基準物使用前未烘至恒重,則標定的NaOH標準溶液的濃度偏高,再用NaOH標準溶液滴定時,消耗的體積不變,根據酸堿滴定原理,仍導致NH4Cl產品的含量比實際含量偏大,
故答案為:偏大.
點評 本題考查侯氏制堿法、溶解度、物質的分離提純、物質含量測定等,題目難度中等,側重考查學生對流程的分析和基礎知識的靈活的應用.


 名師點撥卷系列答案
名師點撥卷系列答案 英才計劃期末調研系列答案
英才計劃期末調研系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
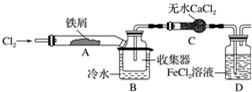 FeCl3在現代工業生產中應用廣泛,某化學研究性學習小組模擬工業流程制備無水FeCl3.經查閱資料得知:無水FeCl3在空氣中易潮解,加熱易升華.他們設計了制備無水FeCl3的實驗方案,裝置示意圖(加熱及夾持裝置略去)及操作步驟如下:
FeCl3在現代工業生產中應用廣泛,某化學研究性學習小組模擬工業流程制備無水FeCl3.經查閱資料得知:無水FeCl3在空氣中易潮解,加熱易升華.他們設計了制備無水FeCl3的實驗方案,裝置示意圖(加熱及夾持裝置略去)及操作步驟如下:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 合成氨反應需使用催化劑,說明催化劑可以促進該平衡向生成氨的方向移動 | |
| B. | 常溫下,用蒸餾水不斷稀釋醋酸,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值變小 | |
| C. | 反應SiO2(s)+3C(s)=SiC(s)+2CO(g)室溫下不能自發進行,則該反應的△H<0 | |
| D. | 對于Ca(OH)2的沉淀溶解平衡,升高溫度,Ca(OH)2的溶解速率增大,Ksp減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
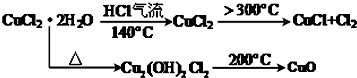
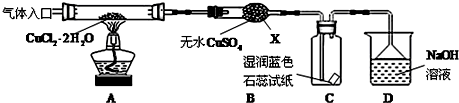
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的NaOH溶液時,選擇甲基橙作指示劑.請填寫下列空白:
某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的NaOH溶液時,選擇甲基橙作指示劑.請填寫下列空白:| 滴定次數 | 待測NaOH溶液的體積/mL | 0.100 0mol/L鹽酸的體積/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
| 第一次 | 25.00 | 0.10 | 26.11 | 26.01 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.32 | 26.31 | 25.99 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com