
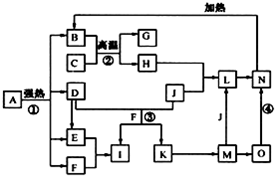
 仔細閱讀圖,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氫化物,且F在常溫下為液態;C、H是日常生活中最為常見的金屬單質,J是氣態非金屬單質,O是白色沉淀,且B、H、L、M、N、O中含有同種元素(圖中部分反應物或產物已略去).請按要求回答:
仔細閱讀圖,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氫化物,且F在常溫下為液態;C、H是日常生活中最為常見的金屬單質,J是氣態非金屬單質,O是白色沉淀,且B、H、L、M、N、O中含有同種元素(圖中部分反應物或產物已略去).請按要求回答:分析 F是氧化物和氫化物,且F在常溫下為液態,則F是H2O,C、H是日常生活中最常見的金屬單質,應該為Al和Fe,結合轉化關系中,B+C=G+H,可知是鋁熱反應,C為Al,H為Fe,G是Al2O3,O是白色沉淀且B、H、L、M、N、O中含有同種元素,證明O是Fe(OH)2,N為Fe(OH)3,B為Fe2O3,J是氣態非金屬單質,能發生反應和鐵直接生成L,也可以利用鐵和K反應生成的M,M和J反應生成L,所以L為FeCl3,M為FeCL2,J為Cl2,判斷K為HCl;D是形成酸雨的主要污染物判斷為SO2,則I是H2SO4,E為SO3,以此解答該題.
解答 解:F是氧化物和氫化物,且F在常溫下為液態,則F是H2O,C、H是日常生活中最常見的金屬單質,應該為Al和Fe,結合轉化關系中,B+C=G+H,可知是鋁熱反應,C為Al,H為Fe,G是Al2O3,O是白色沉淀且B、H、L、M、N、O中含有同種元素,證明O是Fe(OH)2,N為Fe(OH)3,B為Fe2O3,J是氣態非金屬單質,能發生反應和鐵直接生成L,也可以利用鐵和K反應生成的M,M和J反應生成L,所以L為FeCl3,M為FeCL2,J為Cl2,判斷K為HCl;D是形成酸雨的主要污染物判斷為SO2,則I是H2SO4,E為SO3,
(1)應①是分解反應,反應中生成的B(Fe2O3)、D(SO2)、E(SO3)、F(H2O)的物質的量之比為1:1:1:14,依據反應前后原子守恒可以推斷出A的化學式,為FeSO4•7H2O,配平化學方程式得到2FeSO4•7H2O$\frac{\underline{\;強熱\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O,
故答案為:2FeSO4•7H2O$\frac{\underline{\;強熱\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O;
(2)反應②是鋁熱反應,反應易引發,反應放出大量熱量,在工業生產上的一種用途是野外焊接鋼軌,故答案為:野外焊接鋼軌;
(3)反應③是二氧化硫和氯氣在水溶液中的反應生成硫酸和鹽酸,反應的離子方程式:Cl2+SO2+2H2O═4H++SO42-+2Cl-;反應④是氫氧化亞鐵被氧化生成氫氧化鐵的反應的化學方程式為4Fe(OH)2+O2+2H2O═4Fe(OH)3 ,
故答案為:Cl2+SO2+2H2O═4H++SO42-+2Cl-;4Fe(OH)2+O2+2H2O═4Fe(OH)3 ;
(4)C是Al、H是Fe,I是H2SO4,常溫下冷的濃硫酸與鐵或鋁能發生鈍化現象而阻止進一步被氧化,所以可用鐵或鋁制容器儲運濃硫酸,
故答案為:冷的濃硫酸與鐵或鋁制容器接觸時,在表面生成一層致密的氧化膜,阻止金屬繼續與酸反應而使金屬“鈍化”,所以可用鐵或鋁制容器儲運濃硫酸.
點評 本題以Fe、Al、S及其化合物為載體考查了無機物推斷,為高考常見題型,側重于學生的分析能力的考查,涉及鋁熱反應、離子方程式的書寫、電解原理等知識點,綜合性較強,根據物質的特殊現象、特殊性質等知識點來推斷,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:推斷題
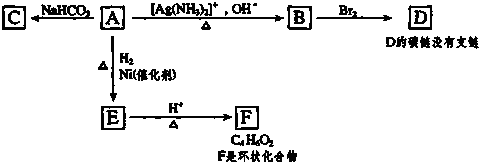
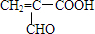 ;
;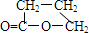 ,由E生成F的反應類型是酯化反應.
,由E生成F的反應類型是酯化反應.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
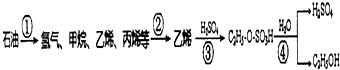 以石油為原料制備乙醇的轉化流程圖如下所示:跟如圖流程圖相關的說法中正確的是( )
以石油為原料制備乙醇的轉化流程圖如下所示:跟如圖流程圖相關的說法中正確的是( )| A. | 流程圖①中產物均為烴類,產物均為可燃性氣體 | |
| B. | 流程圖①中需減壓分餾,②中需分餾分離出乙烯 | |
| C. | 流程圖③中發生加成反應,④中發生取代反應 | |
| D. | 乙醇、硫酸都能夠使蛋白質變性,都可用于皮膚消毒 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  | |
| B. |  | |
| C. |  | |
| D. |  |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 遇到石蕊試液變紅的溶液:Na+、NH4+、K+、NO3- | |
| B. | 遇[Fe(CN)6]3-產生藍色沉淀的溶液:Ca 2+、Cl-、ClO-、Fe3+ | |
| C. | 水電離出的c(OH-)=1×10-12 mol/L的溶液:S2O3-、Cl-、NO3-、Na+ | |
| D. | 與鋁反應產生大量氫氣的溶液:Ba 2+、HCO3-、I-、Fe3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| J | ||||
| R |
 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.| 選項 | a | b | c | d |
| x | 溫度 | 溫度 | 加入H2的物質的量 | 加入甲的物質的量 |
| y | 平衡常數K | 甲的物質的量 | 甲的轉化率 | 生成物物質的量總和 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com