
【題目】某元素 R 的最高價氧化物的水化物分子式是 HnRO2n﹣2,則在氣態氫化物中 R 元素的化合價是( )
A.3n﹣10B.12﹣3nC.3n﹣4D.3n﹣12
科目:高中化學 來源: 題型:
【題目】甲~辛等元素在周期表中的相對位置如下表。甲與戊的原子序數相差3,戊的一種單質是自然界硬度最大的物質,丁與辛屬同周期元素,下列判斷正確的是( )
![]()
A.金屬性:甲>乙>丁
B.原子半徑:辛>己>戊
C.丙與庚的原子核外電子數相差3
D.乙的單質在空氣中燃燒生成只含離子鍵的化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗中需配制1.0 mol/L的NaOH溶液950 mL,假如其他操作均是準確無誤,以下情況會引起配制溶液濃度偏高的是
A.稱取40.0gNaOH固體
B.容量瓶水洗后未烘干直接使用
C.定容時俯視
D.搖勻后發現液面低于刻度線,繼續加水至液面與刻度線平齊
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 聚乙烯塑料和天然橡膠均不能使溴水褪色
B. 2-丁烯分子中所有原子有可能在同一平面
C. 丙烯和環己烷的二氯代物的數目相同(不考慮立體異構)
D. 將溴乙烷和氫氧化鈉的乙醇溶液共熱產生的氣體通入溴水中,溶液褪色,說明有乙烯生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E是原子序數依次增大的五種短周期主族元素,其中A的原子序數是B和D原子序數之和的1/4,C元素的單質與熱水緩慢反應,且該單質可做鋁熱反應的引燃劑,甲和丙是D元素的兩種常見氧化物,乙是B元素的單質,0.005mol/L丁溶液的pH=2,它們之間的轉化關系如圖所示(部分反應物省略),下列敘述正確的是
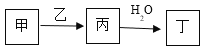
A. C、D的簡單離子均能促進水的電離
B. C、E兩元素形成化合物中既含有離子鍵又含共價鍵
C. A、D分別與B元素形成的化合物都是大氣污染物
D. E的氧化物水化物的酸性大于D的氧化物水化物的酸性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表的一部分,請參照元素①-⑨在表中的位置,回答下列問題:

(1)表中用于半導體材料的元素在周期表中的位置________________________。
(2)寫出短周期金屬性最強的元素的離子結構示意圖:_____。
(3)③、④、⑤三元素離子半徑從大到小的順序是________________填離子符號)。
(4)②、③、④的氣態氫化物,穩定性最強的是_______________填化學式)。
(5)設計實驗證明⑤、⑥的金屬性強弱__________________________。
(6)在一定條件下,利用置換反應可實現物質之間的轉化(僅限于①-⑨中涉及的元素)
①同族元素之間,則反應可能為_____________。
②不同族元素之間,則反應可能為_____________(以上反應各寫一條化學方程式即可)。
(7)將⑨的單質通入石蕊溶液中發生的顏色變化如下圖,請在方框內填寫出導致該階段顏色變化的主要粒子符號。_____________、_____________、_____________。
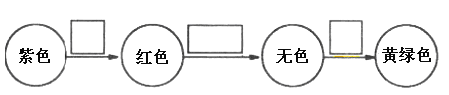
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃煤廢氣中的氮氧化物(NOx)、CO2、SO2等氣體,常用下列方法處理,以實現節能減排、廢物利用等。
已知:25 ℃時,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7
(1)處理煙氣中的SO2常用液吸法。室溫條件下,將煙氣通入濃氨水中得到(NH4)2SO3溶液,0.1mol/L(NH4)2SO3溶液的pH____(填“>”“<”或“=”)7。將煙氣通入 (NH4)2SO3溶液可以繼續吸收SO2 ,用離子方程式表示出能吸收二氧化硫的原因_________。
(2)用活性炭可以還原處理氮氧化物,有關反應為C(s)+2NO(g) ![]() N2(g)+CO2(g)。在恒容條件下,能判斷該反應一定達到化學平衡狀態的依據是 _______(填選項編號)。
N2(g)+CO2(g)。在恒容條件下,能判斷該反應一定達到化學平衡狀態的依據是 _______(填選項編號)。
A.單位時間內生成2n mol NO(g)的同時消耗n mol CO2(g)
B.混合氣體的密度不再發生改變
C.反應體系的壓強不再發生改變
D.混合氣體的平均相對分子質量不再改變
(3)有科學家經過研究發現,用CO2和H2在210~290℃,催化劑條件下可轉化生成甲醇蒸汽和水蒸氣。
①230℃,向容器中投入0.5molCO2和1.5molH2,當轉化率達80%時放出熱量19.6kJ能量,寫出該反應的熱化學方程式_______________________________________。
②一定條件下,往2L恒容密閉容器中充入1.0molCO2和3.0molH2,在不同催化劑作用下,相同時間內CO2的轉化率隨溫度變化如圖1所示:
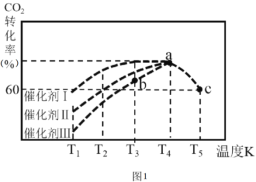
催化劑效果最佳的是催化劑 ______ (填“I”,“Ⅱ”,“Ⅲ”)。b點v(正)___v(逆) (填“>” ,“< ”,“=”)。此反應在a點時已達平衡狀態,a點的轉化率比c點高的原因是_______。已知容器內的起始壓強為100kPa,則圖中c點對應溫度下反應的平衡常數Kp=________。(保留兩位有效數字) (Kp為以分壓表示的平衡常數,分壓=總壓×物質的量分數)。
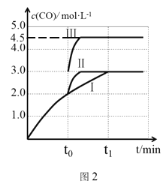
(4)一定條件下,CO2和H2也可以發生反應CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH<0,一定溫度下,在3 L容積可變的密閉容器中,已知c(CO)與反應時間t變化曲線Ⅰ如圖2所示,若在t0時刻分別改變一個條件,曲線Ⅰ變為曲線Ⅱ或曲線Ⅲ。當曲線Ⅰ變為曲線Ⅱ時,改變的條件是____。當曲線Ⅰ變為曲線Ⅲ時,改變的條件是________。
CO(g)+H2O(g) ΔH<0,一定溫度下,在3 L容積可變的密閉容器中,已知c(CO)與反應時間t變化曲線Ⅰ如圖2所示,若在t0時刻分別改變一個條件,曲線Ⅰ變為曲線Ⅱ或曲線Ⅲ。當曲線Ⅰ變為曲線Ⅱ時,改變的條件是____。當曲線Ⅰ變為曲線Ⅲ時,改變的條件是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值。下列說法正確的是
A. 常溫下,2.7g鋁片投入足量的濃硫酸中,鋁失去的電子數為0.3NA
B. 4.0g由H218O與D2O組成的混合物中所含中子數為2NA
C. 標準狀況下,11.2LHF含有0.5NA個HF分子
D. 電解精煉銅時轉移了NA個電子,陽極溶解32g銅
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在一個充滿CO2的鋁制易拉罐中加入適量的NaOH溶液,并密封,易拉罐會慢慢變癟,原因是____________(用化學方程式表示,下同)后又慢慢鼓起來,原因是________________。
(2)寫出還原鐵粉與水蒸氣反應的化學方程式_____________________。
(3)實驗室用碳酸鈣與鹽酸反應制取CO2氣體,反應的離子方程式:___________;常用澄清石灰水檢驗CO2氣體的離子方程式是__________________________________。將表面附有鐵銹(成分是Fe2O3)的鐵釘放入稀硫酸中,開始反應的離子方程式是________________________________;反應片刻后,可觀察到有氣體產生,其離子方程式是________________________。
(4)人體胃液中有胃酸(0.2%~0.4%的鹽酸),起殺菌、幫助消化等作用,但胃酸的量不能過多或過少,它必須控制在一定范圍內,當胃酸過多時,醫生通常用“小蘇打片”或“胃舒平”給病人治療。
①用小蘇打片(NaHCO3)治療胃酸過多的離子方程式為___________________________________________。
②如果病人同時患有胃潰瘍,此時最好服用胃舒平[主要成分是Al(OH)3],反應的離子方程式為________________________________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com