
【題目】燃煤廢氣中的氮氧化物(NOx)、CO2、SO2等氣體,常用下列方法處理,以實現節能減排、廢物利用等。
已知:25 ℃時,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7
(1)處理煙氣中的SO2常用液吸法。室溫條件下,將煙氣通入濃氨水中得到(NH4)2SO3溶液,0.1mol/L(NH4)2SO3溶液的pH____(填“>”“<”或“=”)7。將煙氣通入 (NH4)2SO3溶液可以繼續吸收SO2 ,用離子方程式表示出能吸收二氧化硫的原因_________。
(2)用活性炭可以還原處理氮氧化物,有關反應為C(s)+2NO(g) ![]() N2(g)+CO2(g)。在恒容條件下,能判斷該反應一定達到化學平衡狀態的依據是 _______(填選項編號)。
N2(g)+CO2(g)。在恒容條件下,能判斷該反應一定達到化學平衡狀態的依據是 _______(填選項編號)。
A.單位時間內生成2n mol NO(g)的同時消耗n mol CO2(g)
B.混合氣體的密度不再發生改變
C.反應體系的壓強不再發生改變
D.混合氣體的平均相對分子質量不再改變
(3)有科學家經過研究發現,用CO2和H2在210~290℃,催化劑條件下可轉化生成甲醇蒸汽和水蒸氣。
①230℃,向容器中投入0.5molCO2和1.5molH2,當轉化率達80%時放出熱量19.6kJ能量,寫出該反應的熱化學方程式_______________________________________。
②一定條件下,往2L恒容密閉容器中充入1.0molCO2和3.0molH2,在不同催化劑作用下,相同時間內CO2的轉化率隨溫度變化如圖1所示:
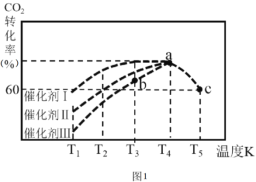
催化劑效果最佳的是催化劑 ______ (填“I”,“Ⅱ”,“Ⅲ”)。b點v(正)___v(逆) (填“>” ,“< ”,“=”)。此反應在a點時已達平衡狀態,a點的轉化率比c點高的原因是_______。已知容器內的起始壓強為100kPa,則圖中c點對應溫度下反應的平衡常數Kp=________。(保留兩位有效數字) (Kp為以分壓表示的平衡常數,分壓=總壓×物質的量分數)。
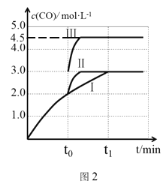
(4)一定條件下,CO2和H2也可以發生反應CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH<0,一定溫度下,在3 L容積可變的密閉容器中,已知c(CO)與反應時間t變化曲線Ⅰ如圖2所示,若在t0時刻分別改變一個條件,曲線Ⅰ變為曲線Ⅱ或曲線Ⅲ。當曲線Ⅰ變為曲線Ⅱ時,改變的條件是____。當曲線Ⅰ變為曲線Ⅲ時,改變的條件是________。
CO(g)+H2O(g) ΔH<0,一定溫度下,在3 L容積可變的密閉容器中,已知c(CO)與反應時間t變化曲線Ⅰ如圖2所示,若在t0時刻分別改變一個條件,曲線Ⅰ變為曲線Ⅱ或曲線Ⅲ。當曲線Ⅰ變為曲線Ⅱ時,改變的條件是____。當曲線Ⅰ變為曲線Ⅲ時,改變的條件是________。
【答案】> SO32-+ SO2+ H2O= 2HSO3- BD CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H= - 49kJ/mol 催化劑I > 該反應為放熱反應,溫度升高,平衡逆向移動 8.3×10-4或1/1200kPa-2 加入催化劑 將容器快速壓縮至2L
CH3OH(g)+H2O(g) △H= - 49kJ/mol 催化劑I > 該反應為放熱反應,溫度升高,平衡逆向移動 8.3×10-4或1/1200kPa-2 加入催化劑 將容器快速壓縮至2L
【解析】
(1)(NH4)2SO3溶液中存在NH4+和SO32-的水解,結合NH3·H2O和H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7分析水解能力的大小,判斷溶液的酸堿性; (NH4)2SO3溶液吸收SO2 生成NH4HSO3,據此寫出發生反應的離子方程式;(2)恒容條件下,反應達到平衡的標志依據“變量不變”方法判斷,正逆反應速率相同,各組分含量保持不變;
(3)①根據圖1可知0.5molCO2和1.5molH2轉化率達80%時放熱23-3.4=19.6KJ,然后按比例計算:CO2(g)+3H2(g)CH3OH(g)+H2O(g)的△H得出該反應的熱化學方程式;②由圖象知:反應Ⅰ在較低溫度T3時CO2就達到80%的轉化率,故催化劑效果最佳的反應是反應Ⅰ;T3的b點時,反應未達到限度,故v(正)>v(逆);該反應為放熱反應,T4反應已經達到平衡,升高溫度到T5平衡向逆反應移動,從而使CO2的轉化率降低。故T4的a點轉化率比T5的c點高;
c點時時,CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始(mol):1 30 0
轉化(mol):0.6 1.8 0.6 0.6
平衡(mol):0.41.2 0.60.6
代入平衡常數表達式計算;
(4)圖象分析曲線Ⅰ變化為曲線Ⅱ是縮短反應達到平衡的時間,最后達到相同平衡狀態,體積是可變得是恒壓容器,說明改變的是加入了催化劑;當曲線Ⅰ變為曲線Ⅲ時一氧化碳物質的量增大,反應是氣體體積不變的反應,可變容器中氣體體積和濃度成反比,氣體物質的量不變。
(1)已知NH3·H2O的電能平衡常數大于H2SO3的Ka2,則在(NH4)2SO3溶液中NH4+的水解能力小于SO32-的水解程度,可知溶液顯堿性,即pH>7; (NH4)2SO3溶液吸收SO2 生成NH4HSO3,發生反應的離子方程式為SO32-+ SO2+ H2O= 2HSO3-;(2)在恒容條件下,能判斷該反應一定達到化學平衡狀態的依據是正逆反應速率相同,個組分含量不變,C(s)+2NO(g)N2(g)+CO2(g);A.單位時間內生成2nmol NO(g)的同時消耗nmol CO2(g),說明反應逆向進行,不能說明反應達到平衡狀態,故A不符合;B.碳是固體.當平衡發生移動,氣體質量會發生變化,容器體積不變,所以混合氣體的密度不再發生改變可以說明反應達到平衡狀態,故B符合;C.反應前后氣體總物質的量不變,反應體系的壓強始終不發生改變,不能判定平衡,故C不選;D.C為固體,混合氣體的平均相對分子質量保持不變,可知氣體的質量不變,為平衡狀態,故D選;故答案為BD;(3)①已知0.5molCO2和1.5molH2轉化率達80%時放熱23-3.4=19.6KJ,則該反應的熱化學方程式:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-![]() ×2=-49kJmol-1;②由圖象知:反應Ⅰ在較低溫度T3時CO2就達到80%的轉化率,催化劑效果最佳的反應是反應Ⅰ,T3的b點時,反應未到限度,故v(正)>v(逆);該反應為放熱反應,T4反應已經達到平衡,升高溫度到T5平衡向逆反應移動,從而使CO2的轉化率降低。T4的a點轉化率比T5的c點高,c點時:
×2=-49kJmol-1;②由圖象知:反應Ⅰ在較低溫度T3時CO2就達到80%的轉化率,催化劑效果最佳的反應是反應Ⅰ,T3的b點時,反應未到限度,故v(正)>v(逆);該反應為放熱反應,T4反應已經達到平衡,升高溫度到T5平衡向逆反應移動,從而使CO2的轉化率降低。T4的a點轉化率比T5的c點高,c點時:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始(mol):1 30 0
轉化(mol):0.6 1.8 0.6 0.6
平衡(mol):0.41.2 0.60.6
在恒容恒溫條件下,氣體的壓強與氣體的物質的量成正比,則平衡時總壓強P總=100kPa×![]() =70 kPa,該反應的平衡常數Kp=
=70 kPa,該反應的平衡常數Kp=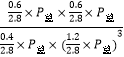 =8.3×10-4 kPa-2;(4)圖象分析曲線Ⅰ變化為曲線Ⅱ是縮短反應達到平衡的時間,最后達到相同平衡狀態,體積是可變得是恒壓容器,說明改變的是加入了催化劑;當曲線Ⅰ變為曲線Ⅲ時一氧化碳物質的量增大,反應是氣體體積不變的反應,可變容器中氣體體積和濃度成反比,氣體物質的量不變,曲線Ⅰ,體積為3L,一氧化碳濃度為3mol/L,改變條件不好為曲線Ⅱ,一氧化碳濃度為4.5mol/L,則體積壓縮體積為:3:V=4.5:3,V=2L,所以將容器的體積快速壓縮至2L滿足條件。
=8.3×10-4 kPa-2;(4)圖象分析曲線Ⅰ變化為曲線Ⅱ是縮短反應達到平衡的時間,最后達到相同平衡狀態,體積是可變得是恒壓容器,說明改變的是加入了催化劑;當曲線Ⅰ變為曲線Ⅲ時一氧化碳物質的量增大,反應是氣體體積不變的反應,可變容器中氣體體積和濃度成反比,氣體物質的量不變,曲線Ⅰ,體積為3L,一氧化碳濃度為3mol/L,改變條件不好為曲線Ⅱ,一氧化碳濃度為4.5mol/L,則體積壓縮體積為:3:V=4.5:3,V=2L,所以將容器的體積快速壓縮至2L滿足條件。


 智能訓練練測考系列答案
智能訓練練測考系列答案 計算高手系列答案
計算高手系列答案科目:高中化學 來源: 題型:
【題目】下列反應中,可用離子方程式![]() +
+![]() =
=![]() 表示的是
表示的是
A.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
B.Mg(OH)2+2HCl=MgCl2+2H2O
C.![]()
D.![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將1molI2(g)和2molH2(g)置于某2L密閉容器中,在一定溫度下發生反應:I2(g)+H2(g)![]() 2HI(g) △H<0,并達平衡,HI的體積分數ω(HI)隨時間變化如圖曲線
2HI(g) △H<0,并達平衡,HI的體積分數ω(HI)隨時間變化如圖曲線

(1)達平衡時,I2(g)的物質的量濃度為____________,H2(g)的平衡轉化率為___________,在此溫度下,該反應的平衡常數K=____________(保留一位小數)。
(2)若改變反應條件下,在甲條件下ω(HI)的變化如圖曲線(I)所示,在乙條件下ω(HI)的變化如圖曲線(III)所示。則甲條件可能是_________(填入下列條件的序號,下同),乙條件可能是__________。
① 恒容條件下,升高溫度
② 恒容條件下,降低溫度
③ 恒溫條件下,縮小反應容器體積
④ 恒溫條件下,擴大反應容器體積
⑤ 恒溫恒容條件下,加入適當催化劑
(3)若保持溫度不變,在另一相同的2L密閉容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),發生反應達平衡時,HI的體積分數仍為0.60,則a、b、c的應滿足的關系是___________(用含一個a、b、c的代數式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某元素 R 的最高價氧化物的水化物分子式是 HnRO2n﹣2,則在氣態氫化物中 R 元素的化合價是( )
A.3n﹣10B.12﹣3nC.3n﹣4D.3n﹣12
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B 兩種元素為同一族第三周期和第四周期元素,若 A 元素的原子序數為 x,則 B 元素的原子序數可能為( )
①x+2 ②x+8 ③x+18 ④x+32
A.③B.②C.②③D.①②
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可以證明可逆反應N2+3H2![]() 2NH3已達到平衡狀態的是
2NH3已達到平衡狀態的是
①一個N≡N鍵斷裂的同時,有3個H﹣H鍵斷裂
②一個N≡N鍵斷裂的同時,有6個N﹣H鍵斷裂
③其他條件不變時,混合氣體平均相對分子質量不再改變
④恒溫恒容時,體系壓強不再改變
⑤NH3、N2、H2的體積分數都不再改變
⑥恒溫恒容時,混合氣體密度保持不變
⑦正反應速率v(H2)=0.6molL﹣1min﹣1,逆反應速率v(NH3)=0.4molL﹣1min﹣1
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如右圖是研究二氧化硫性質的微型實驗裝置(實驗時用另一表面皿扣在上面)。現用75%硫酸溶液和亞硫酸鈉晶體反應制取SO2氣體并進行實驗,實驗現象很明顯。下列說法中錯誤的是

A.品紅溶液褪色
B.紫色石蕊溶液先變紅后褪色
C.酸性KMnO4溶液紫色褪去
D.含酚酞的NaOH溶液紅色變淺
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫時,下列溶液的pH或微粒的物質的量濃度關系錯誤的是
A. 某溶液中由水電離出的c(H+)=1×10-amol·L-1,若a>7時,該溶液pH一定為14-a
B. 0.1mol·L-1的KHA溶液,其pH=10,c(K+)>c(HA-)>c(OH-)>c(A2-)
C. 將0.2mol·L-1的某一元酸HA溶液和0.1mol·L-1NaOH溶液等體積混合后溶液pH大于7,則反應后的混合液:c(HA)>c(Na+)>c(A-)
D. 等體積、等物質的量濃度的Na2CO3溶液與 NaHCO3溶液混合:2c(Na+)=3c(CO32-)+3c( HCO3-)+3c(H2CO3)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、M、W五種短周期元素。X原子的質子數與電子層數相同,W原子核外電子數是M原子最外層電子數的2倍,Y、Z、M、W在周期表中的相對位置如圖所示。下列說法不正確的是

A. 原子半徑:W>Y>Z>M>X
B. 熱穩定性:XM>X2Z
C. 僅由X、Y、Z三種元素形成的化合物中不可能含離子鍵
D. WM4分子中每個原子最外層均滿足8電子結構
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com