
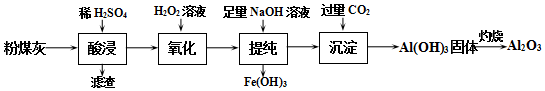
分析 制備Al2O3的流程:粉煤灰的主要成分為Al2O3和SiO2,(含少量雜質FeO、Fe2O3),加稀硫酸,Al2O3、FeO、Fe2O3轉化為離子,SiO2不溶于硫酸,過濾,濾渣為SiO2,濾液中含有Al3+、Fe2+、Fe3+,加雙氧水,Fe2+被氧化為Fe3+,氫氧化鋁為兩性物質,加入足量的氫氧化鈉Fe3+轉化為沉淀,鋁離子生成偏鋁酸根離子,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,過濾,濾渣為氫氧化鐵,在濾液中通入過量的二氧化碳,生成Al(OH)3,過濾、洗滌、干燥、煅燒得到Al2O3.
(1)Al3+易水解,“酸浸”時需加入過量的稀硫酸,抑制Al3+水解,H2O2與Fe2+在酸性條件下反應生成鐵離子和水,為后續反應提供H+;
(2)H2O2與Fe2+在酸性條件下反應生成鐵離子和水,根據氧化還原反應中得失電子數相等書寫;
(3)“提純”過程中,當加入NaOH溶液達到沉淀量最大時,生成Fe(OH)3,Al(OH)3沉淀,溶質為硫酸鈉;
(4)根據Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)計算c(OH-);
(5)碳酸的酸性強于偏鋁酸,“沉淀”過程中,通入過量CO2生成氫氧化鋁沉淀.
解答 解:(1)Al3+易水解,水解生成H+,水解的離子方程式為:Al3++3H2O?Al(OH)3+3H+,加入過量硫酸能抑制其水解,H2O2與Fe2+在酸性條件下反應生成鐵離子和水,反應的離子方程式為:2Fe2++H2O2+2H+=2Fe3++2H2O,同時為后續反應加雙氧水,氧化Fe2+為Fe3+提供H+,
故答案為:抑制Al3+水解(或為后續反應提供H+);
(2)H2O2中O元素的化合價為-1價,具有氧化性,O元素的化合價(0→-2),H2O2為氧化劑,Fe2+中Fe元素的化合價為+2價,具有還原性,Fe元素的化合價(+2→+3),Fe元素化合價升高被氧化,Fe2+為還原劑,每1mol過氧化氫反應轉移電子為2mol,根據得失電子數相等,反應的離子方程式為:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案為:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)沉淀達最大量,Fe3++3OH-═Fe(OH)3↓,Al3++3OH-═Al(OH)3↓,沉淀為Fe(OH)3、Al(OH)3,溶質為Na2SO4,溶液中c(SO42-):c(Na+)=1:2,
故答案為:1:2;
(4)Ksp[Fe(OH)3]=1×10-39,“提純”過程中,當c(Fe3+)<10-6 mol•L-1時,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-),c(OH-)=$\root{3}{\frac{1×1{0}^{-39}}{1×1{0}^{-6}}}$=1×10-11,
故答案為:1×10-11;
(5)碳酸的酸性強于偏鋁酸,“沉淀”過程中,通入過量CO2,發生反應為:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,
故答案為:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
點評 本題以氧化鋁提取工藝流程為載體,考查元素化合物性質及相互轉化、氧化還原、離子方程式、實驗基本操作等知識點,注意把握制備原理、把握物質的性質以及相關反應方程式的書寫,難點是離子方程式的書寫及平衡常數計算,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
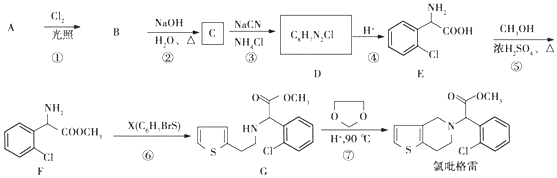
 ;②
;②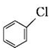 中氯原子較難水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$
中氯原子較難水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$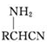
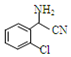 ;C分子中最多有14個原子共平面.
;C分子中最多有14個原子共平面.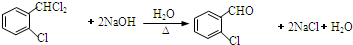 .
.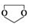 ,需要經歷的反應類型有②①③④③(填寫編號).①加成反應 ②消去反應 ③取代反應 ④氧化反應 ⑤還原反應,寫出制備化合物
,需要經歷的反應類型有②①③④③(填寫編號).①加成反應 ②消去反應 ③取代反應 ④氧化反應 ⑤還原反應,寫出制備化合物 的最后一步反應HOCH2CH2OH+HCHO$\stackrel{酸}{→}$
的最后一步反應HOCH2CH2OH+HCHO$\stackrel{酸}{→}$ .
.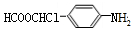 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 制備氯氣時嚴格檢查裝置的氣密性,并設置尾氣吸收裝置 | |
| B. | 稀釋濃硫酸時,將水倒入濃硫酸中,使用玻璃棒不斷攪拌 | |
| C. | 在敞口容器中進行銅與濃硝酸的反應,并觀察生成的氣體 | |
| D. | 向一支試管中加入少量水,向其中投入一塊黃豆大小的鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電負性:As>Cl>P | B. | 熱穩定性:HCl>HBr>AsH3 | ||
| C. | 第一電離能:Br>Se>As | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑤ | B. | ①④⑥ | C. | ②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 乙酰苯胺是一種白色有光澤片狀結晶或白色結晶粉末,是磺胺類藥物的原料,可用作止痛劑、退熱劑、防腐劑和染料中間體.乙酰苯胺的制備原理為:
乙酰苯胺是一種白色有光澤片狀結晶或白色結晶粉末,是磺胺類藥物的原料,可用作止痛劑、退熱劑、防腐劑和染料中間體.乙酰苯胺的制備原理為: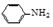 +CH3COOH?
+CH3COOH?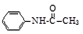 +H2O
+H2O| 名稱 | 式量 | 性狀 | 密度/g/cm3 | 沸點/℃ | 溶解度 | |
| 苯 胺 | 93 | 無色油狀液體,具有還原性 | 1.00 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
| 乙 酸 | 60 | 無色液體 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰苯胺 | 135 | 白色晶體 | 1.22 | 304 | 微溶于冷水,溶于熱水 | 易溶于乙醇、乙醚 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com