
| 甲同學 | 乙同學 | |
| 選用試劑 | A1C13溶液、NaOH溶液 | A12(SO4)3溶液、氨水 |
| 操作 | 向AlCl3溶液中逐滴加入NaOH溶液至過量 | 向A12(SO4)3溶液中逐滴加入氨水至過量 |
| 實驗現象 | 先產生白色沉淀,然后沉淀逐漸消失 | |
| 化學方程式 | AlCl3+3NaOH=Al(OH)3↓+3NaClAl(OH)3+NaOH=NaAlO2+2H2O | A12(SO4)3+6NH3•H2O═2A1(OH)3↓+3(NH4)2SO4 |
| 離子方程式 | Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O | Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
分析 氫氧化鋁是兩性氫氧化物,白色絮狀物質.既能與強酸反應生成鹽和水,也能與強堿反應生成鹽和水.所以在實驗室制取氫氧化鋁時一般用可溶性鋁鹽與弱堿如一水合氨發生反應制取;
(1)甲:向AlCl3溶液中逐滴加入NaOH溶液至過量的實驗現象開始生成氫氧化鋁沉淀,繼續滴加氫氧化鈉溶液氫氧化鋁沉淀會溶解,
乙:向A12(SO4)3溶液中逐滴加入氨水至過量,生成氫氧化鋁沉淀,氫氧化鋁不溶于氨水;
據此書寫化學方程式和離子方程式;
(2)依據氫氧化鋁是兩性氫氧化物,溶于強酸強堿,不溶于弱酸弱堿,可以選擇氯化鋁溶液和氨水或硝酸鋁溶液和氨水;
(3)實驗室制取氫氧化鋁最好選用可溶性鋁鹽和氨水;氫氧化鋁可以和氫氧化鈉溶液發生反應.
解答 解:(1)向AlCl3溶液中逐滴加入NaOH溶液至過量的實驗現象:甲中先產生白色沉淀,然后沉淀逐漸消失,反應的化學方程式和離子方程式為:AlCl3+3NaOH=Al(OH)3↓+3NaCl Al(OH)3+NaOH=NaAlO2+2H2O 離子方程式:甲 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O;
向A12(SO4)3溶液中逐滴加入氨水至過量,乙中產生白色沉淀,沉淀不溶解,化學方程式和離子方程式為:A12(SO4)3+6NH3•H2O═2A1(OH)3↓+3(NH4)2SO4 ,Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案為:
| 甲同學 | 乙同學 | |
| 選用試劑 | ||
| 操作 | ||
| 實驗現象 | 先產生白色沉淀,然后沉淀逐漸消失 | |
| 化學方程式 | AlCl3+3NaOH=Al(OH)3↓+3NaCl Al(OH)3+NaOH=NaAlO2+2H2O | |
| 離子方程式 | Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O | Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
點評 不同考查了鋁的化合物性質的分析應用,主要是氫氧化鋁的制備方法和氫氧化鋁的兩性分析應用,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 用已脫硫的煤作燃料 | |
| B. | 開發氫能等能源代替化石燃料,有利于保護環境 | |
| C. | 開發利用可燃冰是緩解能源緊缺的唯一途徑 | |
| D. | 用“綠色化學”工藝,使原料盡可能轉化為所需要的物質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

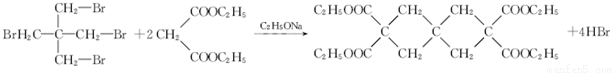
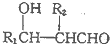 (R1、R2為烴基或H)
(R1、R2為烴基或H)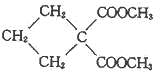 +HBr+HCl
+HBr+HCl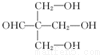 .
. .
.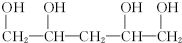 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知:①CH3CH2OH$→_{170℃}^{濃H_{2}SO_{4}}$CH2=CH2↑+H20,CH2=CH2+Br2→BrCH2-CH2Br
已知:①CH3CH2OH$→_{170℃}^{濃H_{2}SO_{4}}$CH2=CH2↑+H20,CH2=CH2+Br2→BrCH2-CH2Br| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 通常狀況下的狀態 | 無色液體 | 無色液體 | 無色液體 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 熔點/℃ | -130 | 9 | -116 |
| 沸點/℃ | 78.5 | 132 | 34.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 第一次實驗 | 第二次實驗 | 第三次實驗 | |
| D中固體用量 | 2.0g | 2.0g | 2.0g |
| 氫氣的體積 | 334.5mL | 336.0mL | 337.5mL |
| 步驟 | 實驗操作 | 預測現象和結論 |
| ① | 往不再產生氯氣的裝置中,加入NaCl固體,繼續加熱 | 若有黃綠色氣體生成,則假設1成立 |
| ② | 往不再產生氯氣的裝置中,加入濃硫酸并繼續加熱 | 若有黃綠色氣體生成,則假設2成立 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化硅的結構式:O=Si=O | |
| B. | H2O沸點高于NH3,是因為H2O分子間存在氫鍵而NH3分子間不存在氫鍵 | |
| C. | 含有金屬離子的晶體一定是離子晶體 | |
| D. | 分子晶體中一定存在分子間作用力,不一定存在共價鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com