
| A. | 高壓的條件下,有利于工業上氨氣的合成 | |
| B. | 高壓比常壓有利于合成SO3的反應 | |
| C. | 由H2、I2(g)、HI(g)氣體組成的平衡體系加壓后顏色變深 | |
| D. | 黃綠色的氯水光照后顏色變淺 |
分析 勒夏特列原理是:如果改變影響平衡的一個條件(如濃度、壓強或溫度等),平衡就向能夠減弱這種改變的方向移動.勒夏特列原理適用的對象應存在可逆過程,若與可逆過程無關,與平衡移動無關,則不能用勒夏特列原理解釋.
解答 解:A、工業合成氨反應中,加壓會向著生成氨氣的方向進行,利于提高氨氣的產率,能用勒夏特利原理解釋,故A錯誤;
B、存在平衡2SO2+O2(g)?2SO3(g),正反應為氣體體積減小的反應,增大壓強,平衡向正反應移動,有利于合成SO3,能用平衡移動原理解釋,故B錯誤;
C、由H2、I2(g)、HI(g)氣體組成的平衡體系是一個前后氣體系數和相等的體系,改變壓強,化學平衡不會移動,不能用勒夏特利原理解釋,故C正確;
D、存在Cl2+H2O?HCl+HClO,生成的次氯酸見光分解,促進平衡正向進行,故氯水光照后顏色變淺,能用勒夏特利原理解釋,故D錯誤;
故選C.
點評 本題考查了勒夏特列原理的使用條件,難度不大,注意使用勒夏特列原理的前提必須是可逆過程,且平衡發生移動.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
 ,
,
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
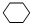 ,名稱是環己烷.
,名稱是環己烷.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10 mL 0.1 mol/L氨水與10 mL 0.1 mol/L鹽酸混合,c(Cl-)>c( NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol/L NH4Cl溶液與5 mL 0.2 mol/L NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol/L CH3COOH溶液與5 mL 0.2 mol/L NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol/L CH3COONa溶液與6 mL 1 mol/L鹽酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
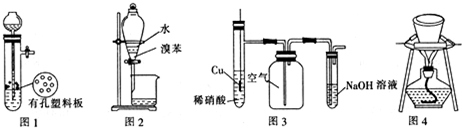
| A. | 圖1裝置用于Cu和濃H2SO4反應制取少量的SO2氣體 | |
| B. | 圖2裝置用于分離水和溴苯的混合物 | |
| C. | 圖3裝置用于制備并收集NO氣體 | |
| D. | 圖4裝置用于除去碳酸氫鈉固體中的少量碳酸鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ,回答下列問題:
,回答下列問題: $\stackrel{一定條件下}{→}$
$\stackrel{一定條件下}{→}$ +2H2O.
+2H2O. .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com