
 X、Y、Z、W都是中學化學常見的物質,其中X、Y、Z均含有同一種元素.在一定條件下相互轉化的關系如圖所示(部分反應中的H2O已略去).請按要求回答下列問題:
X、Y、Z、W都是中學化學常見的物質,其中X、Y、Z均含有同一種元素.在一定條件下相互轉化的關系如圖所示(部分反應中的H2O已略去).請按要求回答下列問題:
| ||
| ||


 字詞句篇與同步作文達標系列答案
字詞句篇與同步作文達標系列答案科目:高中化學 來源: 題型:
| A、該反應中Fe3+是氧化劑 |
| B、該反應中Cu被氧化了 |
| C、2mol Fe3+反應后共得到4NA個電子 |
| D、氧化產物與還原產物的物質的量之比為1:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
13 6 |
12 6 |
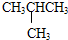
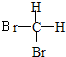 和
和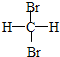 E.CH4和CH3(CH2)2CH3
E.CH4和CH3(CH2)2CH3查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
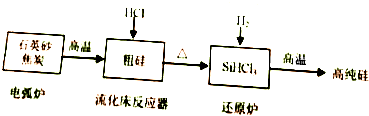 硅在地殼中的含量較高.硅及其化合物的開發由來已久,在現代生活中有廣泛應用,回答下列問題:
硅在地殼中的含量較高.硅及其化合物的開發由來已久,在現代生活中有廣泛應用,回答下列問題:| 物質 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸點/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化學 來源: 題型:
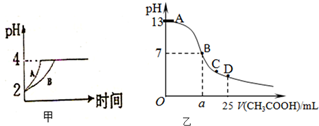 化學學科中的平衡理論主要包括:化學平衡、電離平衡、水解平衡和溶解平衡四種,且均符合勒夏特列原理.請回答下列問題:
化學學科中的平衡理論主要包括:化學平衡、電離平衡、水解平衡和溶解平衡四種,且均符合勒夏特列原理.請回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com