
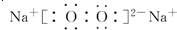 .
.分析 A、B、C、D、E都是短周期元素,原子半徑D>C>A>E>B,其中A、B處在同一周期,A、C處在同一主族,四種元素在周期表中的大致相對位置為: ,B的氫化物H2B是一種最常見的無色液體,則B為O元素;C原子最外層上的電子數是D原子最外層電子數的4倍,且D為金屬,則C、D最外層電子數分別為4、1,故A為C元素,C為Si元素,D為Na元素,E的原子半徑介于C、O之間,可推知E為N元素,據此解答.
,B的氫化物H2B是一種最常見的無色液體,則B為O元素;C原子最外層上的電子數是D原子最外層電子數的4倍,且D為金屬,則C、D最外層電子數分別為4、1,故A為C元素,C為Si元素,D為Na元素,E的原子半徑介于C、O之間,可推知E為N元素,據此解答.
解答 解:A、B、C、D、E都是短周期元素,原子半徑D>C>A>E>B,其中A、B處在同一周期,A、C處在同一主族,四種元素在周期表中的大致相對位置為: ,B的氫化物H2B是一種最常見的無色液體,則B為O元素;C原子最外層上的電子數是D原子最外層電子數的4倍,且D為金屬,則C、D最外層電子數分別為4、1,故A為C元素,C為Si元素,D為Na元素,E的原子半徑介于C、O之間,可推知E為N元素.
,B的氫化物H2B是一種最常見的無色液體,則B為O元素;C原子最外層上的電子數是D原子最外層電子數的4倍,且D為金屬,則C、D最外層電子數分別為4、1,故A為C元素,C為Si元素,D為Na元素,E的原子半徑介于C、O之間,可推知E為N元素.
(1)C為Si元素,在元素周期表的第三周期ⅣA族,故答案為:三、ⅣA;
(2)在五種元素中,能形成的最簡單的液態或氣態氫化物有H2O、NH3、CH4、SiH4,由于非金屬性:O>N>C>Si,故氫化物穩定性:H2O>NH3>CH4>SiH4,
故答案為:H2O>NH3>CH4>SiH4;
(3)A與B形成的三原子分子為CO2,結構式是O=C=O,B與D形成的原子個數比為1:1的化合物為Na2O2,電子式是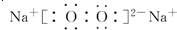 ,
,
故答案為:O=C=O;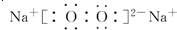 ;
;
(4)反應2H2(g)+O2(g)=2H2O(l) 的△H=2×a kJ/mol+bkJ/mol-4×c kJ/mol=-(4c-2a-b)kJ/mol,1gH2為0.5mol,在B2中完全燃燒放出的熱量為(4c-2a-b)kJ/mol×$\frac{0.5mol}{2mol}$=$\frac{(4c-2a-b)}{4}$kJ,
故答案為:$\frac{(4c-2a-b)}{4}$kJ;
(5)E的一種氫化物叫肼,其分子中E原子與氫原子個數比為1:2,分子式為N2H4,正極發生還原反應,且電解質呈堿性,氧氣得電子生成氫氧根離子,電極方程式為O2+2H2O+4e-═4OH-,
故答案為:O2+2H2O+4e-═4OH-.
點評 本題考查元素位置結構性質的關系,題目難度中等,關鍵是正確推斷元素的種類,注意根據原子位置關系及半徑大小找出其在周期表中的相對位置.


 鴻圖圖書寒假作業假期作業吉林大學出版社系列答案
鴻圖圖書寒假作業假期作業吉林大學出版社系列答案科目:高中化學 來源: 題型:填空題
 現有A、B、C、D、E、F六種物質或粒子,其中A、B、C、D都具有如圖所示的結構或結構單元,(圖中正四面體以外可能有的部分未畫出,虛線不表示化學鍵或分子間作用力,X、Y可以相同也可以不同).A、B的晶體類型相同.單質A的同素異形體能與B物質發生置換反應.C、D、E、F含有相等的電子數,且D是陽離子,D與F的組成元素相同.C、E、F的晶體類型相同,由E構成的物質常溫下呈液態.
現有A、B、C、D、E、F六種物質或粒子,其中A、B、C、D都具有如圖所示的結構或結構單元,(圖中正四面體以外可能有的部分未畫出,虛線不表示化學鍵或分子間作用力,X、Y可以相同也可以不同).A、B的晶體類型相同.單質A的同素異形體能與B物質發生置換反應.C、D、E、F含有相等的電子數,且D是陽離子,D與F的組成元素相同.C、E、F的晶體類型相同,由E構成的物質常溫下呈液態.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 )俗稱為肉桂酸芐酯,主要用在配制人造龍涎香,在東方型香精中作為定香劑,也用作皂用、化妝用及食用果實香精的調香原料.以下是我校化學興趣小組設計的由芳香烴A為起始原料制備肉桂酸芐酯的合成路線:
)俗稱為肉桂酸芐酯,主要用在配制人造龍涎香,在東方型香精中作為定香劑,也用作皂用、化妝用及食用果實香精的調香原料.以下是我校化學興趣小組設計的由芳香烴A為起始原料制備肉桂酸芐酯的合成路線:

 ;
;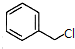 +
+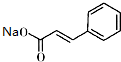 $\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$
$\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$ +NaCl;
+NaCl; (寫結構簡式,若有多種可能,只寫一種).
(寫結構簡式,若有多種可能,只寫一種).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 往某固體中滴加稀鹽酸有氣泡產生--該固體一定是碳酸鹽 | |
| B. | 往某溶液中滴加氯化鋇溶液,產生不溶于稀硝酸的白色沉淀--該溶液一定含有硫酸根離子 | |
| C. | 生石灰塊投入水中,水會沸騰--生石灰變成熟石灰的過程是放熱反應 | |
| D. | 往品紅溶液中通入某種氣體,使品紅褪色--該氣體一定是二氧化硫 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯能使酸性KMnO4溶液褪色 | |
| B. | 苯與稀硝酸、稀硫酸混合加熱,生成硝基苯 | |
| C. | 苯與溴水混合振蕩,靜置,下層液體幾乎為無色 | |
| D. | 1mol苯與2mol氫氣發生加成反應生成1mol環己烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com