
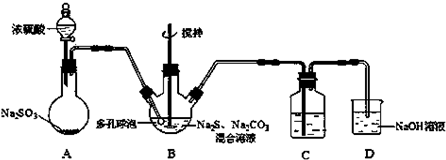
分析 裝置A為二氧化硫的制取:Na2SO3+H2SO4(濃)=Na2SO4+SO2↑+H2O,B裝置為Na2S2O3的生成裝置:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,二氧化硫能和品紅作用,二氧化硫能被高錳酸鉀氧化,能與溴單質,上述溶液均褪色,所以裝置C中盛放品紅、溴水或KMnO4溶液,其作用是檢驗裝置B中SO2的吸收效率,二氧化硫有毒,不能直接排放到空氣中,裝置D作用為尾氣吸收裝置,吸收未反應的二氧化硫.
(1)裝置A為二氧化硫的制取,亞硫酸鈉和濃硫酸發生復分解反應生成硫酸鈉和水和二氧化硫;
(2)根據題目信息SO2、Na2S和Na2CO3反應生成Na2S2O3,結合質量守恒確定產物并配平,硫代硫酸鈉晶體易溶于水,難溶于乙醇生成的硫代硫酸鈉粗品可用乙醇洗滌;
(3)裝置B的作用是檢驗裝置A中SO2的吸收效率,說明B中物質能與二氧化硫反應,且有明顯的現象,一般可為品紅、溴水或KMnO4溶液;加快反應速率,可增大接觸面積,增大濃度、升高溫度等;
(4)已知室溫時CaCO3飽和溶液的pH=9.5,若要檢驗氫氧化鈉存在,需加入過量CaCl2溶液,把Na2CO3轉化為CaCO3,再測量溶液的pH,若pH大于9.5,說明含有NaOH.
解答 解:(1)裝置A為二氧化硫的制取,亞硫酸鈉和濃硫酸發生復分解反應:Na2SO3+H2SO4(濃)=Na2SO4+SO2↑+H2O,生成二氧化硫,
故答案為:Na2SO3+H2SO4(濃)=Na2SO4+SO2↑+H2O;
(2)三頸燒瓶B中制取Na2S2O3反應的總化學反應方程式為:4SO2+2Na2S+Na2CO3=CO2↑+3Na2S2O3,離子反應為:4SO2+2S2-+CO32-=CO2↑+3S2O32-,硫代硫酸鈉晶體易溶于水,難溶于乙醇,乙醇易揮發,生成的硫代硫酸鈉粗品可用乙醇洗滌,
故答案為:4SO2+2S2-+CO32-=CO2↑+3S2O32-;乙醇;
(3)裝置B的作用是檢驗裝置A中SO2的吸收效率,說明B中物質能與二氧化硫反應,且有明顯的現象,一般可為品紅、溴水或KMnO4溶液等,如A中SO2吸收效率低,則B中進入較多的二氧化硫,導致B中溶液顏色很快褪色,加快反應速率,可增大氣體與液體的接觸面積,增大濃度,加快二氧化硫的流速、升高溫度等,
故答案為:品紅、溴水或KMnO4溶液;褪色;控制SO2的流速(或增大SO2的接觸面積或適當升高溫度);
(4)檢驗氫氧化鈉存在,需加入過量CaCl2溶液,把Na2CO3轉化為CaCO3,再測量溶液的pH,實驗方案為:取少量樣品于試管(燒杯)中,加水溶解,加入過量的CaCl2溶液,振蕩(攪拌),靜置,用pH計測定上層清液的pH,若pH>9.5,則含有NaOH,
故答案為:取少量樣品于試管(燒杯)中,加水溶解,加入過量的CaCl2溶液,振蕩(攪拌),靜置,用pH計測定上層清液的pH,若pH>9.5,則含有NaOH.
點評 本題考查了硫代硫酸鈉晶體制備實驗方案的設計和制備過程分析應用,主要是實驗基本操作的應用、二氧化硫的性質的探究,側重于學生的分析能力、實驗能力的考查,為高考常見題型和高頻考點,注意把握物質的性質以及實驗原理的探究,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,8 g CH4含有4NA個氫原子 | |
| B. | 2gD216O中含有的質子數為2NA個 | |
| C. | 1 mol Cu與足量FeCl3溶液反應,轉移2NA個電子 | |
| D. | 通常狀況下,2.24 L氮氣含有0.1NA個N2分子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
時間 (s)濃度 mol•L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
| C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 物質 | 熔點/℃ | 沸點/℃ | 其他 |
| CCl4 | -23 | 76 | 與TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮濕空氣產生白霧 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應過程中,一定有化學鍵的斷裂和形成 | |
| B. | 日常生活中的廢舊電池會污染環境,所以應集中填埋處理 | |
| C. | 化學反應過程中,分子的種類和數目一定發生改變 | |
| D. | 放熱反應的反應速率,一定比吸熱反應的反應速率快 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 原子序數依次增大的四種主族元素A、B、C、D分別處于第一至第四周期,其中A原子核是一個質子;B原子核外電子有6種不同的運動狀態,B與C可形成正四面體型分子,D原子外圍電子排布為3d104s1.請回答下列問題:
原子序數依次增大的四種主族元素A、B、C、D分別處于第一至第四周期,其中A原子核是一個質子;B原子核外電子有6種不同的運動狀態,B與C可形成正四面體型分子,D原子外圍電子排布為3d104s1.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在O2參與的反應中,1 mol O2作氧化劑時得到的電子數一定是4NA | |
| B. | 50mL18.4 mol/L濃硫酸與足量銅加熱反應,生成SO2分子的數目為0.46NA | |
| C. | 1 molFe溶于過量硝酸,電子轉移數為2NA | |
| D. | 78g Na2O2晶體中含有的離子數目為3NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com