
分析 加入足量鐵粉,則溶液中FeCl3、HCl、CuSO4完全反應生成FeCl2、FeSO4,反應后溶液中Fe2+的物質的量與原混合溶液中Cu2+的物質的量之比為2:1,設Cu2+的物質的量為n,則反應后溶液中Fe2+的物質的量為2n,根據反應Cu2++Fe=Cu+Fe2+可知,反應后生成的FeSO4的物質的量為n,則原溶液中硫酸根離子的物質的量為n;原溶液中FeCl3、HCl與Fe完全反應生成的FeCl2的物質的量為n,根據質量守恒可知Cl-的物質的量為:n(Cl-)=2n(FeCl2)=2n,再根據在同一溶液中c(SO42-):c(Cl-)=n(SO42-):n(Cl-)計算出原混合溶液中SO42-與Cl-的物質的量濃度之比.
解答 解:加入的鐵粉足量,則溶液中FeCl3、HCl、CuSO4完全反應生成FeCl2、FeSO4,
反應后溶液中Fe2+的物質的量與原混合溶液中Cu2+的物質的量之比為2:1,設Cu2+的物質的量為n,則反應后溶液中Fe2+的物質的量為2n,
根據反應Cu2++Fe=Cu+Fe2+可知,反應后生成的FeSO4的物質的量為n,則硫酸根離子的物質的量為n,
原溶液中FeCl3、HCl與Fe完全反應生成的FeCl2的物質的量為n,根據質量守恒可知Cl-的物質的量為:n(Cl-)=2n(FeCl2)=2n,
由于在同一溶液中,則原溶液c(SO42-):c(Cl-)=n(SO42-):n(Cl-)=n:2n=1:2,
故答案為:1:2.
點評 本題考查了混合物反應的計算,題目難度中等,明確發生反應的實質為解答關鍵,注意掌握守恒思想在化學計算中的應用方法,試題培養了學生的化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 同時減少 | B. | 同時增大 | C. | v(正)增大,v(逆)減少 | D. | v(正)減少,v(逆)增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 單質沸點:X>Y | B. | 陽離子的氧化性:W>Y | ||
| C. | 氧化物的水化物的酸性:Z>X | D. | Y、Z的簡單離子均能抑制水的電離 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸式鹽的水溶液一定顯酸性 | |
| B. | 碳酸溶液中的氫離子濃度是碳酸根離子濃度的2倍 | |
| C. | 室溫下,pH=3的亞硫酸溶液中的氫離子濃度與pH=11的氨水中的氫氧根離子濃度相等 | |
| D. | 室溫時,將pH=5的H2SO4溶液稀釋1000倍,則c(H+):c (SO42-)=2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
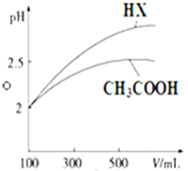 已知25℃時部分弱電解質的電離平衡常數數據如表所示:
已知25℃時部分弱電解質的電離平衡常數數據如表所示:| 化學式 | CH3COOH | H2CO3 | HClO | |
| 電離平衡常數 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 無色氣體的質量為0.2g | |
| B. | 原混合物中鐵的質量分數無法計算 | |
| C. | 實驗中消耗的H2SO4物質的量為0.1mol | |
| D. | 溶液中金屬離子物質的量為0.02mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 不變 | B. | 增大 | C. | 減小 | D. | 無法判斷 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用稀氨水鑒別Al3+、Mg2+和Ag+ | |
| B. | 用核磁共振氫譜鑒別1-溴丙烷和2-溴丙烷 | |
| C. | 用酸性KMnO4溶液鑒別CH3CH═CHCH2OH和CH3CH2CH2CHO | |
| D. | 用Ba(NO3)2溶液鑒別Cl-、SO42-和CO32- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com