
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |

分析 (1)①Fe2O3(s)+3C(石墨)=2Fe(s+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g),根據蓋斯定律計算反應的焓變;
(2)化學平衡常數K=$\frac{生成物平衡濃度系數次方的乘積}{反應物平衡濃度系數次方的乘積}$,根據溫度與平衡常數的關系來回答;
(3)①濃度商Qc=1,小于平衡常數,反應向正反應進行,令平衡時參加反應的CO為xmol,利用三段式表示出平衡時各組分的物質的量,根據平衡常數列方程計算,在結合轉化率定義計算;
②a.反應前后氣體質量變化,體積不變,若容器內氣體密度恒定時,標志反應達到平衡狀態;
b.固體量增加不影響化學平衡,增加Fe2O3不能提高CO的轉化率;
c.乙相當于在甲平衡的基礎上加入1molCO,反應速率加快;
d.乙容器內濃度商Qc=0.125,小于平衡常數,反應向正反應進行,令平衡時乙中參加反應的CO為ymol,利用三段式表示出平衡時各組分的物質的量,根據平衡常數列方程計算,結合①中的計算判斷;
(4)①原電池的正極和電解池的陰極可以得到保護;
②裝置為原電池,若用d裝置保護鐵,X極的電極材料應比鐵活潑;
(5)根據溶度積常數計算.
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1;①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g),根據蓋斯定律得到反應的焓變=+489.0kJ•mol-1-3×(+172.5kJ•mol-1)=-28.5kJ•mol-1.
即a=-28.5,故答案為:-28.5;
(2)Fe2O3(s)+3CO(g)$\frac{\underline{\;高溫\;}}{\;}$2Fe(s)+3CO2(g)的平衡常數K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,該反應是放熱反應,升高溫度,化學平衡正向移動,該反應的平衡常數K值將減小,故答案為:$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$;減小;
(3)①在T℃時,該反應的平衡常數K=64,甲容器內濃度商Qc=1,小于平衡常數,反應向正反應進行,設消耗一氧化碳物質的量為x,則:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
起始量(mol):1 1
變化量(mol):x x
平衡量(mol):1-x 1+x
反應前后氣體體積不變,可以用物質的量代替濃度計算平衡常數,故$\frac{(1+x)^{3}}{(1-x)^{3}}$=64,解得x=0.6,
故CO的轉化率=$\frac{0.6mol}{1mol}$×100%=60%
故答案為:60%;
②a.反應前后氣體質量變化,體積不變,若容器內氣體密度恒定時,標志反應達到平衡狀態,故a正確;
b.Fe2O3為固體量,增加其用量,不影響化學平衡移動,不能提高CO的轉化率,故b錯誤;
c.乙相當于在甲平衡的基礎上加入1molCO,反應速率加快,故乙容器中CO平衡時的速率更高,故c錯誤;
d.乙容器內濃度商Qc=0.125,小于平衡常數,反應向正反應進行,令平衡時乙中參加反應的CO為ymol,則:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
起始量(mol):2 1
變化量(mol):y y
平衡量(mol):2-y 1+y
反應前后氣體體積不變,可以用物質的量代替濃度計算平衡常數,故$\frac{(1+y)^{3}}{(2-y)^{3}}$=64,解得y=1.4,故平衡時乙容器內CO為2mol-1.4mol=0.6mol,由①中的計算可知平衡時,甲中CO為1mol-0.6mol=0.4mol,故甲、乙容器中CO的平衡濃度之比為0.4mol:0.6mol=2:3,故d正確;
故答案為:ad;
(4)①a裝置中鐵連接電源的正極,為陽極,發生氧化反應,加速其腐蝕,a錯誤;b裝置中鐵連接電源的負極,為陰極,能保護鐵不被腐蝕,是外接電源的陰極保護法,b正確;c裝置中,鋅比鐵活潑,鋅作負極,鐵被保護,是犧牲陽極的陰極保護法,c正確;故答案為:bc;
②若d裝置能夠保護鐵,則X的活潑性應比鐵活潑,使右側裝置為原電池,左側裝置為電解池,構成外接電源的陰極保護法,X可以是Zn、Al等活潑的金屬,故答案為:鋅;
(5)根據氫氧化鎂和氫氧化鐵的溶解平衡以及溶度積表達式,則當兩種沉淀共存且溶液的pH=8時,
c(Mg2+)=$\frac{{K}_{sp}}{c(O{H}^{-})^{2}}$=$\frac{5.61×1{0}^{-12}}{1{0}^{-12}}$═5.61mol/L,
c(Fe3+)=$\frac{{K}_{sp}}{c(O{H}^{-})^{3}}$=$\frac{2.64×1{0}^{-39}}{1{0}^{-18}}$=2.64×10-21mol/L,
所以 c(Mg2+):c(Fe3+)=5.61:2:64×10-21=2.215×1021;
故答案為:2.215×1021.
點評 本題考查了熱化學方程式和蓋斯定律計算應用,平衡常數計算應用,化學平衡三段式列式計算方法,原電池原理的分析判斷,溶度積常數的計算,題目難度中等.


科目:高中化學 來源: 題型:填空題
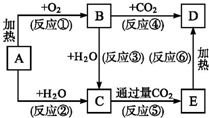 框圖中A為一種常見的單質,B、C、D、E是含A元素的常見化合物,它們的焰色反應均為黃色.
框圖中A為一種常見的單質,B、C、D、E是含A元素的常見化合物,它們的焰色反應均為黃色.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 它是一種白色粉末,溶解度小于Na2CO3 | |
| B. | 加熱至200℃左右,可完全分解,利用這種性質,可由NaHCO3制取純堿 | |
| C. | 與Na2CO3相同質量時,分別跟足量鹽酸反應后,則NaHCO3可得到較多的二氧化碳 | |
| D. | 它是一種碳酸鹽 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某反應的焓變小于零,該反應一定能自發進行 | |
| B. | 用濕潤的PH試紙測稀鹽酸溶液的pH為3.52 | |
| C. | 原電池是將化學能轉變為電能的裝置 | |
| D. | 草木灰(K2CO3)是鉀肥,硫酸銨是氮肥,兩者混合施用可以提高肥效 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
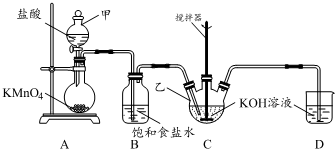 實驗室用圖所示裝置制備KClO溶液,并通過KClO溶液與Fe(NO3)3溶液的反應制備高效水處理劑K2FeO4.
實驗室用圖所示裝置制備KClO溶液,并通過KClO溶液與Fe(NO3)3溶液的反應制備高效水處理劑K2FeO4.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
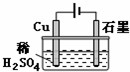
| A. | 電解過程中,銅電極上有H2產生 | |
| B. | 電解初期,主反應方程式為Cu+H2SO4$\frac{\underline{\;通電\;}}{\;}$CuSO4+H2↑ | |
| C. | 電解一定時間后,石墨電極上有銅析出 | |
| D. | 整個電解過程中,H+的濃度幾乎不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 醛基的結構簡式:-CHO | B. | 甲烷的電子式: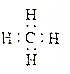 | ||
| C. | 乙炔分子的結構式:H-C≡C-H | D. | 乙醇的分子式:C2H5OH |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com