
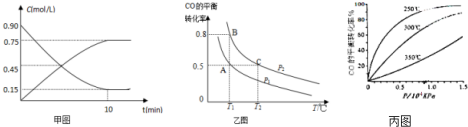
分析 (1)利用蓋斯定律,1式加2式的二倍即可得到該方程式及焓變;
(2)根據反應速率v=$\frac{△c}{△t}$,結合物質表示的反應速率之比等于物質前邊的系數之比來計算;
(3)①平衡標志是正逆反應速率相同,各成分濃度保持不變分析判斷選項;
②正反應方向為氣體體積減小的方向,T1℃時比較CO的轉化率,轉化率越大,則壓強越大;
(4)從橫坐標上一點,畫一條平行于縱坐標的虛線,看相同壓強下不同溫度時CO的平衡轉化率,溫度越低轉化率越低,說明,升溫時平衡向逆向移動.
解答 解:(1)已知①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a KJ/mol
②CO(g)+2H2(g)=CH3OH(g)△H=b KJ/mol,①+②×2可得到2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol,故答案為:2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol;
(2)用甲醇表示的反應速率v=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),氫氣表示的反應速率是甲醇的2倍,即0.15mol/(L•min),故答案為:0.15mol/(L•min);
(3)①A.H2的消耗速率等于CH3OH的生成速率的2倍,不能說明正逆反應速率相等,不一定平衡,故A錯誤;
B.H2的體積分數不再改變是化學平衡的特征,達到了平衡,故B正確;
C.體系中混合氣體的密度不再改變,說明氣體的物質的量不變反應達平衡狀態,故C正確;
D.體系中氣體的平均摩爾質量等于質量和物質的量的比值,物質的量變化,質量不變,所以當體系中氣體的平均摩爾質量不再改變,證明達到了平衡,故D正確.
故選BCD;
②正反應方向為氣體體積減小的方向,T1℃時比較CO的轉化率,轉化率越大,則壓強越大,圖象中PB轉化率大于PA,可知PA<PB,溫度越高反應速率越快,壓強越大反應速率越快,所以υ(C)>υ(B)>υ(A),故答案為:υ(C)>υ(B)>υ(A);
(4)從橫坐標上一點0.5處,畫一條平行于縱坐標的虛線,看相同壓強下不同溫度時CO的平衡轉化率,溫度越高轉化率越低,說明,升溫時平衡向逆向移動.
第二問:實際生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是工業生產要考慮速經濟效益,要考慮速度和效率,壓強越大需要的條件越高,花費越大.
故答案為:<;在1.3×104kPa下,CO的轉化率已經很高,如果增加壓強CO的轉化率提高不大,而生產成本增加,經濟效益低.
點評 本題考查了學生的識圖能力,學會定一議二法分析圖象得方法,這是學生必備的能力,題目難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用火柴點燃酒精燈 | |
| B. | 熄滅酒精燈火焰時,用燈帽蓋滅 | |
| C. | 用酒精燈外焰給物質加熱 | |
| D. | 用燃著的酒精燈去點燃另一盞酒精燈 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 漂白粉是混合物,有效成分是Ca(ClO)2 | |
| B. | 光照氯水有氣泡逸出,該氣體是Cl2 | |
| C. | Cl2能使濕潤的有色布條褪色,說明Cl2具有漂白性 | |
| D. | 實驗室用二氧化錳與稀鹽酸反應制取Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 現象 | 結論 |
| A | 將某溶液與稀鹽酸反應產生的氣體通入澄清石灰水 | 石灰水變渾濁 | 該溶液中一定含有CO32- |
| B | 常溫下,將鐵片浸入足量濃硫酸中 | 鐵片不溶解 | 常溫下,鐵與濃硫酸一定沒有發生化學反應 |
| C | 向某食鹽溶液中滴加淀粉溶液 | 溶液顏色不變 | 該食鹽中一定沒有添加KIO3 |
| D | 向苯酚鈉溶液中滴加乙酸溶液 | 溶液變渾濁 | 相同條件下,乙酸的酸性一定比苯酚強 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 物質 | 熔點/℃ | 沸點/℃ | 密度/(g•cm-3) | 水中溶解性 |
| 甲 | -98 | 57.7 | 0.93 | 可溶 |
| 乙 | -84 | 77 | 0.90 | 可溶 |
| A. | 萃取法 | B. | 過濾法 | C. | 蒸餾法 | D. | 分液法 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CuSO4只是還原劑 | |
| B. | Cu3P既是氧化產物又是還原產物 | |
| C. | P既是氧化劑又是還原劑 | |
| D. | 若有11 mol P參加反應,轉移電子的物質的量為60 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com