
| A. | 將0.l mol•L-1醋酸溶液加水稀釋,溶液中所有離子的濃度都減小 | |
| B. | 0.1 mol/L的一元弱酸HA加水稀釋過程中,$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$ 不變 | |
| C. | 中和pH與體積均相同的鹽酸和醋酸溶液,消耗NaOH的物質的量相同 | |
| D. | 中和10 mL 0.1mol•L-1醋酸與中和100 mL 0.01mol•L-1的醋酸所需同種堿液的量不同 |
分析 A.加水稀釋醋酸,氫離子濃度減小,但氫氧根離子濃度增大;
B.已知Kw=c(H+)•c(OH-),Ka=$\frac{c({A}^{-})c({H}^{+})}{c(HA)}$,由$\frac{Ka}{Kw}$=$\frac{c({A}^{-})}{c(HA)c(O{H}^{-})}$;
C.醋酸是弱酸存在電離平衡,PH相同的鹽酸和醋酸,醋酸溶液濃度大于鹽酸;
D.10 mL 0.1mol•L-1醋酸與100 mL 0.01mol•L-1的醋酸溶液中溶質物質的量相同.
解答 解:A.加水稀釋醋酸,氫離子濃度減小,溫度不變溶液中離子積常數不變,氫氧根離子濃度增大,故A錯誤;
B.已知Kw=c(H+)•c(OH-),Ka=$\frac{c({A}^{-})c({H}^{+})}{c(HA)}$,由$\frac{Ka}{Kw}$=$\frac{c({A}^{-})}{c(HA)c(O{H}^{-})}$,已知Ka和Kw均為常數,所以$\frac{c({A}^{-})}{c(HA)c(O{H}^{-})}$不變,故B正確;
C.醋酸是弱酸存在電離平衡,PH相同的鹽酸和醋酸,醋酸溶液濃度大于鹽酸,中和pH與體積均相同的鹽酸和醋酸溶液,消耗NaOH的物質的量醋酸大于鹽酸,故C錯誤;
D.10 mL 0.1mol•L-1醋酸與100 mL 0.01mol•L-1的醋酸溶液中溶質物質的量相同,中和10 mL 0.1mol•L-1醋酸與中和100 mL 0.01mol•L-1的醋酸所需同種堿液的量相同,故D錯誤;
故選B.
點評 本題考查了弱電解質的電離,明確弱電解質電離特點是解本題關鍵,注意酸的電離平衡常數、水的離子積常數只與溫度有關,與溶液的濃度無關,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 18O、31P | B. | 1H、12C | C. | 14N、23Na | D. | 24Mg、32S |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
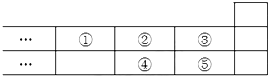
| A. | 元素①位于第二周期第IVA族 | |
| B. | 元素的最高正價是③=⑤ | |
| C. | 最高價氧化物對應水化物的酸性:③>⑤>④ | |
| D. | 氣態氫化物的穩定性:④<②<③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶劑蒸發快,得到的晶體顆粒也較大 | |
| B. | 減壓過濾可過濾膠狀沉淀物,且較為干燥 | |
| C. | 由0.1 mol•L-1一元堿BOH溶液的pH=10,可推知BOH溶液有BOH═B++OH- | |
| D. | 由0.1 mol•L-1一元酸HA溶液的pH=3,可推知NaA溶液有A-+H2O?HA+OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
| 序號 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名稱 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
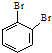 和
和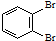
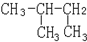 和
和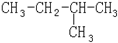
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com