
 天然氣含有硫化氫氣體,回收并綜合利用硫化氫有重要的經濟價值和環境保護意義.如硫化氫可經過一系列反應制得硫酸:
天然氣含有硫化氫氣體,回收并綜合利用硫化氫有重要的經濟價值和環境保護意義.如硫化氫可經過一系列反應制得硫酸:時間 物質 | 0min | 20min | 60min | 90min | 120min |
| H2S | 0.006 | 0.005 | |||
| H2 | 0 | 0.002 | 0.004 | ||
| S2 | 0 | 0.002 | 0.0025 |
分析 (1)已知S的燃燒熱為297kJ•mol-1,熱化學方程式為①S(s)+O2(g)=SO2(g)△H=-297KJ/mol,
H2S完全燃燒的熱化學方程式為②H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O (l)△H=-586kJ/mol,
由蓋斯定律②-①得到H2S不完全燃燒生成固態硫和液態水:H2S(g)+$\frac{1}{2}$O2(g)=S(s)+H2O (l);
(2)①Na2S為強堿弱酸鹽,硫離子水解;
②H2S為弱酸,NaHS和Na2S為鹽,弱酸分步電離,鹽完全電離,酸式酸根離子在離子反應中不能拆分;
(3)發生2H2S(g)?2H2(g)+S2(g)的反應,
①60 min到90 minH2S分解了0.001 mol•L-1,同時段應生成H20.001 mol•L-1和S20.0005 mol•L-1,即容器內的H2和S2濃度分別為0.005 mol•L-1和0.0025 mol•L-1,而120 min時的S2濃度仍為0.0025 mol•L-1;
②結合K=$\frac{{c}^{2}({H}_{2})c({S}_{2})}{{c}^{2}({H}_{2}S)}$計算;
(4)硫化氫放電后生成硫蒸氣(化學式S2),則負極上硫化氫失去電子;
(5)硫酸溶液和氫氧化鈉溶液反應,為中和反應,放出熱量.
解答 解:(1)已知S的燃燒熱為297kJ•mol-1,熱化學方程式為①S(s)+O2(g)=SO2(g)△H=-297KJ/mol,
H2S完全燃燒的熱化學方程式為②H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O (l)△H=-586kJ/mol,
由蓋斯定律②-①得到H2S不完全燃燒生成固態硫和液態水:H2S(g)+$\frac{1}{2}$O2(g)=S(s)+H2O (l)△H=-279kJ/mol,
故答案為:H2S(g)+$\frac{1}{2}$O2(g)=S(s)+H2O (l)△H=-279kJ/mol;
(2)①Na2S為強堿弱酸鹽,硫離子水解,則溶液顯堿性,故答案為:堿;
②A.H2S+OH-=HS-+H2O,為酸堿中和的離子反應,故A正確;
B.HS-+H2O=H2S+OH-,水解為可逆反應,應將“=”改為“?”,故B錯誤;
C.HS-+H2O?S2-+H3O+,為電離的離子反應,故C正確;
D.S2-+H2O?H2S+2OH-,不符合水解分步進行,以第一步為主,故D錯誤;
故答案為:AC;
(3)發生2H2S(g)?2H2(g)+S2(g)的反應,
①60 min到90 minH2S分解了0.001 mol•L-1,同時段應生成H20.001 mol•L-1和S20.0005 mol•L-1,即容器內的H2和S2濃度分別為0.005 mol•L-1和0.0025 mol•L-1,而120 min時的S2濃度仍為0.0025 mol•L-1,故90 min時反應已達平衡狀態,正、逆反應速率相等,90min時反應速率v(正)=v(逆),故答案為:=;
②$K=\frac{{{c^2}({H_2})•c({S_2})}}{{{c^2}({{H_2}S})}}=\frac{{{{(0.005\;mol•{L^{-1}})}^2}×0.0025\;mol•{L^{-1}}}}{{{{(0.005\;mol•{L^{-1}})}^2}}}=0.0025\;mol•{L^{-1}}$,故答案為:0.0025 mol•L-1;
(4)硫化氫放電后生成硫蒸氣(化學式S2),則負極上硫化氫失去電子,該燃料電池的負極反應式為2H2S-4e-=S2+4H+,故答案為:2H2S-4e-=S2+4H+;
(5)硫酸溶液和氫氧化鈉溶液反應,為中和反應,放出熱量,反應過程的能量變化示意圖為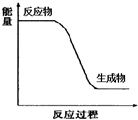 ,故答案為:
,故答案為: .
.
點評 本題考查較綜合,為高頻考點,涉及熱化學反應、鹽類水解、化學平衡的計算及原電池等,側重化學反應原理及應用能力的考查,題目難度中等.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol/LNa2CO3溶液中:2c(Na+)=c(HCO3-)+c(H2CO3)+c(C032-) | |
| B. | 向0.1mol/L氯化銨溶液中滴加濃鹽酸可能有c(NH4+)=c(H+) | |
| C. | pH=4的醋酸與pH=10的NaOH溶液等體積混合后pH>7 | |
| D. | 將0.2mol/LNaA溶液和某濃度的鹽酸等體積混合所得中性溶液中:c(Na+)=c(A-)+c(Cl-)=0.2mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
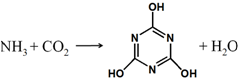 CO2的資源化利用是解決溫室效應的重要途徑,如圖是在一定條件下用NH3捕獲CO2生成重要化工產品三聚氰酸的反應.下列有關三聚氰酸的說法正確的是( )
CO2的資源化利用是解決溫室效應的重要途徑,如圖是在一定條件下用NH3捕獲CO2生成重要化工產品三聚氰酸的反應.下列有關三聚氰酸的說法正確的是( )| A. | 分子式為C3H6N3O3 | B. | 分子中既含有σ鍵又含有π鍵 | ||
| C. | 分子中既含極性鍵,又含非極性鍵 | D. | 生成該物質的上述反應為中和反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:A<D<C<B | |
| B. | 最簡單氫化物的穩定性:D<C | |
| C. | A與C形成的化合物溶于水所得溶液顯堿性 | |
| D. | B與D形成的化合物溶于水所得溶液顯堿性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 糖類不一定都是高分子化合物,但水解產物相同 | |
| B. | 甲苯能使酸性高錳酸鉀溶液褪色,證明甲苯分子中存在單雙鍵交替的結構 | |
| C. | 利用糧食釀酒經過了由淀粉→葡萄糖→乙醇的化學變化過程 | |
| D. | 甲醇、乙二醇(HOCH2CH2OH)互為同系物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
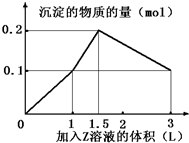 某混合溶液中,含溶質X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物質的量如圖,則符合條件的X、Y、Z分別是( )
某混合溶液中,含溶質X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物質的量如圖,則符合條件的X、Y、Z分別是( )| A. | 氯化鋁、氯化鐵、氫氧化鈉 | B. | 氯化鋁、氯化鎂、氫氧化鈉 | ||
| C. | 偏鋁酸鈉、氯化鋇、硫酸 | D. | 偏鋁酸鈉、氫氧化鋇、硫酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向明礬溶液中加入足量的燒堿溶液:Al3++3OH-=Al(OH)3↓ | |
| B. | 在含有等物質的量的Fe(NO3)2和KI組成的混合溶液中滴入稀鹽酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氫銨溶液中滴加足量的NaOH溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 純堿溶液呈堿性的原因:CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等體積0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常溫下,CH2COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com