
| C、O、Si第一電離能 | 離子半徑Cl-、Na+、O2- | 熔點 | 電負性 |
| Si<C<O | Cl->O2->Na+ | CO2<SiO2 | Cl>Si |
分析 (1)主族元素周期數=電子層數、主族族序數=最外層電子數;Fe為26號元素,根據核外電子排布規律書寫外圍電子排布式;
(2)同周期隨原子序數增大,元素第一電離能呈增大趨勢,同主族自上而下第一電離能減小;
電子層結構相同的離子,核電荷數越大離子半徑越小,電子層越多離子半徑越大;
熔沸點高低一般為:原子晶體>離子晶體>分子晶體;
同周期隨原子序數增大,電負性增大;
(3)注明物質聚集狀態與△H書寫熱化學方程式;
(4)FeO42- 具有強氧化性,在其鈉鹽溶液中加入稀硫酸,溶液變為黃色,說明有Fe3+生成,并有無色氣體產生,根據電子轉移守恒,只能為O元素被氧化,故還生成O2,配平書寫離子方程式.
解答 解:(1)Si元素原子核外有3個電子層,最外層電子數為4,處于周期表中第三周期ⅣA族;Fe為26號元素,核外電子排布為1s22s22p63s23p63d64s2,外圍電子排布式為3d64s2,
故答案為:三、ⅣA;3d64s2;
(2)同周期隨原子序數增大,元素第一電離能呈增大趨勢,同主族自上而下第一電離能減小,故第一電離能:Si<C<O;
電子層結構相同的離子,核電荷數越大離子半徑越小,電子層越多離子半徑越大,故離子半徑:Cl->O2->Na+;
二氧化碳為分子晶體,二氧化硅屬于原子晶體,故熔點:CO2<SiO2;
同周期隨原子序數增大,電負性增大,故電負性:Cl>Si,
故答案為:Si<C<O;Cl->O2->Na+;CO2<SiO2;Cl>Si;
(3)已知甲醇的燃燒熱為726.5KJ/mol,甲醇燃燒的熱化學方程式為:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+H2O(l)△H=-726.5KJ/mol,
故答案為:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+H2O(l)△H=-726.5KJ/mol;
(4)FeO42- 具有強氧化性,在其鈉鹽溶液中加入稀硫酸,溶液變為黃色,說明有Fe3+生成,并有無色氣體產生,根據電子轉移守恒,只能為O元素被氧化,故還生成O2,反應離子方程式為:4 FeO42-+20 H+=4Fe3++3O2↑+10H2O,
故答案為:4 FeO42-+20 H+=4Fe3++3O2↑+10H2O.
點評 本題考查結構性質位置關系應用、核外電子排布、微粒半徑比較、晶體類型與性質、熱化學方程式、離子方程式等,難點是(4)題離子方程式的書寫,注意對基礎知識的理解掌握.


科目:高中化學 來源: 題型:選擇題
| A. | CH3CH2OH$→_{170℃}^{濃硫酸}$CH2═CH2↑+H2O | |
| B. | CH3CHBrCH3+NaOH$→_{△}^{乙醇}$CH3CH═CH2↑+NaBr+H2O | |
| C. | 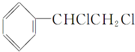 +2NaOH$→_{△}^{乙醇}$ +2NaOH$→_{△}^{乙醇}$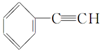 +2NaCl+2H2O +2NaCl+2H2O | |
| D. | 2CH3OH$→_{△}^{濃硫酸}$CH3-O-CH3+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 不同的原子 | B. | 同一元素的不同原子或離子 | ||
| C. | 不同元素的離子 | D. | 不同的元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A組 | B組 |
| Ⅰ.H-I鍵鍵能大于H-Cl鍵能 Ⅱ.H-I鍵鍵能小于H-Cl鍵能 Ⅲ.HI分子間作用力大于HCl分子間作用力 Ⅳ.HI分子間作用力小于HCl分子間作用力 | a.HI比HCl穩定 b.HCl比HI穩定 c.HI沸點比HCl高 d.HI沸點比HCl低 |
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

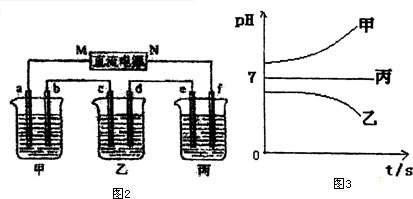
| A. | a為正極,b為負極 | |
| B. | 生產過程中a電極質量減輕 | |
| C. | 電子從b極向a極移動 | |
| D. | 負極反應式為:SO2+2H2O-2e-=SO42-+4H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
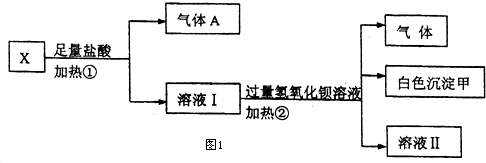
| 陽離子 | Na+、K+、Cu2+ |
| 陰離子 | SO${\;}_{4}^{2-}$、OH- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com