
分析 (1)空氣污染指數就是將常規監測的幾種空氣污染物濃度簡化成為單一的數值形式,并分級表示空氣污染程度和空氣質量狀況,目前計入空氣污染指數的項目主要為:可吸入顆粒物、二氧化硫、二氧化氮等;
(2)元素化合價升高做還原劑被氧化,元素化合價降低做氧化劑被還原,結合反應的離子方程式的定量關系計算0.2mol KMnO4可以需要的二氧化硫物質的量;
(3)二氧化硫和氧氣在浮塵作用下反應生成三氧化硫,三氧化硫和水反應生成硫酸;
(4)依據PH=-lgc(H+)計算得到氫離子濃度;
(5)pH也為4的硫酸溶液,c(H+)=10-4mol/L,得到c(H2SO4)=5×10-5mol/L.
解答 解:(1)空氣污染指數就是將常規監測的幾種空氣污染物濃度簡化成為單一的數值形式,并分級表示空氣污染程度和空氣質量狀況,目前計入空氣污染指數的項目主要為:可吸入顆粒物、二氧化硫、二氧化氮等,空氣質量預報中主要預報城市空氣中SO2、可吸入顆粒的量、氮氧化物,二氧化碳是空氣中的成分,氯氣、氨氣不是空氣中常見的氣體,
故答案為:③;
(2)SO2氣體與酸性KMnO4溶液反應時,MnO4-被還原為Mn2+,SO2被氧化為SO42-,反應的離子方程式為:2MnO4-+5SO2+2H2O=5SO42-+4H++2Mn2+,反應中硫元素化合價升高,SO2做還原劑被氧化,Mn元素化合價降低,KMnO4做氧化劑被還原,結合反應的離子方程式的定量關系計算0.2mol KMnO4可以需要的二氧化硫物質的量0.5mol,
故答案為:還原;0.5mol;
(3)二氧化硫和氧氣在浮塵作用下反應生成三氧化硫,三氧化硫和水反應生成硫酸,酸雨的主要成分是H2SO4.
故答案為:H2SO4;
(4)依據PH=-lgc(H+)計算得到氫離子濃度,若上述酸雨的pH為4,則其中c(H+)=10-4mol/L,
故答案為:10-4;
(5)pH也為4的硫酸溶液,c(H+)=10-4mol/L,得到c(H2SO4)=5×10-5mol/L,溶液中溶質H2SO4的物質的量為5×10-5mol/L,
故答案為:5×10-6mol.
點評 本題考查了二氧化硫性質的分析,酸雨形成過程,氧化還原反應分析,題目難度中等,注意掌握氧化還原反應原理和概念的理解應用,試題培養了學生的分析、理解能力及靈活應用所學知識的能力,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 3mol | B. | 4mol | C. | 5mol | D. | 6mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應能在瞬間完成,并產生大量氣體 | |
| B. | 生成標準狀況下2.24L氣體,該反應轉移電子的物質的量為0.625mol | |
| C. | 該反應中的氧化劑為KNO3 | |
| D. | 被氧化和被還原的N原子的物質的量之比為15:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 則:
則: ;
;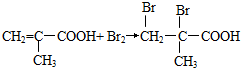 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3CH2 CH2CH3和CH3CH(CH3)2 | B. | CH2=C(CH3)2和CH3CH=CHCH3 | ||
| C. | CH3CH2OH和CH3OCH3 | D. | CH3CH2 CH2COOH 和CH3COOCH2CH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 63 | B. | 36 | C. | 126 | D. | 252 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com