
分析 (1)鐵在冷的濃硫酸中發生鈍化,表面形成致密的氧化膜;
(2)亞鐵離子有還原性,能還原酸性高錳酸鉀溶液而使其褪色;根據硫酸鋇與二氧化硫的關系式計算二氧化硫的體積,再根據體積分數公式計算;
(3)碳素鋼中含有碳,加熱條件下,碳能和濃硫酸反應生成二氧化硫、二氧化碳和水;根據方程式轉移4mole-~~3×22.4L的氣體.
解答 解:(1)常溫下,鐵遇冷的濃硫酸發生氧化還原反應,在鐵表面生成一層致密的氧化物薄膜而阻止了進一步的反應,即發生鈍化現象,所以反應片刻后取出觀察,鐵釘表面無明顯變化,故答案為:鐵釘表面被鈍化;
(2)①亞鐵離子具有還原性,而酸性高錳酸鉀有氧化性,發生氧化還原反應使高錳酸鉀溶液褪色,故答案為:d;
②SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,
所以硫酸鋇和二氧化硫之間的關系式為SO2~BaSO4,設二氧化硫的體積為V,
SO2~~~~BaSO4,
22.4L 233g
V 4.66g
V=0.448l=448mL,所以二氧化硫的體積分數=$\frac{448ml}{560ml}$=80%,
故答案為:80%;
(3)碳素鋼中含有碳,加熱條件下,碳能和濃硫酸反應生成二氧化硫、二氧化碳和水,反應方程式為C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,由方程式可知
4mole-~~3×22.4L,所以0.4mol電子轉移,生成氣體為6.72L,故答案為:C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;6.72.
點評 本題考查了濃硫酸的性質、二氧化硫的性質、常見物質的檢驗等知識點,側重于考查學生綜合運用化學知識的能力和實驗能力,注意常溫下,鐵和冷的濃硫酸不是不反應,而是反應生成了致密的氧化物薄膜而阻止了進一步反應,為易錯點.


科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | c(SO32-)>c(OH-)>c(HSO3-) | B. | c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+) | ||
| C. | 加入少量NaOH固體,Kw增大 | D. | 加入稀鹽酸,c(HSO3-)減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
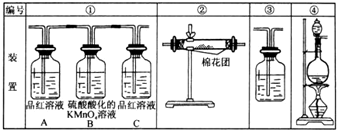 (1)濃硫酸與木炭粉在加熱條件下反應的化學方程式是:C+2H2SO4(濃)=CO2↑+2SO2↑+2H2O
(1)濃硫酸與木炭粉在加熱條件下反應的化學方程式是:C+2H2SO4(濃)=CO2↑+2SO2↑+2H2O查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無色、易揮發,有刺激性氣味的液體 | |
| B. | 濃度為98%以上的濃硝酸叫發煙硝酸,具有脫水性 | |
| C. | 濃硝酸通常顯黃色,因為溶解了少量的二氧化氮 | |
| D. | 硝酸不穩定,濃度越大越易分解 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com