
分析 (1)相同濃度、相同體積的鹽酸和醋酸,其物質的量相等,分別加入足量鋅,生成氫氣速率與氫離子濃度成正比;
(2)相同濃度、相同體積的鹽酸和醋酸,其物質的量相等,分別加入足量鋅,最終生成氫氣的物質的量與酸的物質的量成正比;
(3)若c(H+)相同的①鹽酸②醋酸,分別加入足量的鋅,生成氫氣速率與氫離子濃度成正比;
(4)若c(H+)相同的①鹽酸②醋酸,分別加入足量的鋅,生成氫氣物質的量與酸最終電離出氫離子物質的量成正比;
(5)若c(H+)相同的①鹽酸②醋酸均加水稀釋至原來的100倍后,加水稀釋過程中醋酸繼續電離,而HCl完全電離.
解答 解:(1)相同濃度、相同體積的鹽酸和醋酸,其物質的量相等,分別加入足量鋅,生成氫氣速率與氫離子濃度成正比,開始時c(H+)①>②,所以反應速率①>②,
故答案為:①>②;
(2)相同濃度、相同體積的鹽酸和醋酸,其物質的量相等,分別加入足量鋅,最終生成氫氣的物質的量與酸的物質的量成正比,兩種酸中最終電離出氫離子物質的量相等,所以最終生成氫氣物質的量①=②,
故答案為:①=②;
(3)若c(H+)相同的①鹽酸②醋酸,分別加入足量的鋅,生成氫氣速率與氫離子濃度成正比,開始時兩種溶液中氫離子濃度相等,所以反應速率①=②,故答案為:①=②;
(4)若c(H+)相同的①鹽酸②醋酸,醋酸濃度大于鹽酸,體積相同時醋酸物質的量大于鹽酸,分別加入足量的鋅,生成氫氣物質的量與酸最終電離出氫離子物質的量成正比,所以生成氫氣物質的量①<②,
故答案為:①<②;
(5)若c(H+)相同的①鹽酸②醋酸均加水稀釋至原來的100倍后,加水稀釋過程中醋酸繼續電離,而HCl完全電離,所以稀釋后氫離子濃度①<②,故答案為:①<②.
點評 本題考查弱電解質的電離,為高頻考點,明確影響生成氫氣的物質的量因素、影響化學反應速率因素是解本題關鍵,注意:該題中化學反應速率只與氫離子濃度有關,與電解質強弱無關.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016-2017學年甘肅省高二上第一次學段考試化學卷(解析版) 題型:選擇題
下列與化學反應能量變化相關的敘述正確的是( )
A.反應物總能量低于生成物總能量時,該反應一定不能發生
B.化學鍵的鍵能越大,物質的能量越高
C.一個反應的焓變因反應物的用量和反應條件的改變而發生改變
D.應用蓋斯定律,可計算某些難以直接測量的反應焓變
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 22.9g/mol | B. | 26 | C. | 26 g/mol | D. | 29.3 g/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
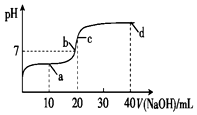 室溫時,向20mL 0.1mol•L-1一元酸HA溶液中滴入0.1mol•L-1的NaOH溶液,溶液的pH變化曲線如圖所示.下列說法正確的是( )
室溫時,向20mL 0.1mol•L-1一元酸HA溶液中滴入0.1mol•L-1的NaOH溶液,溶液的pH變化曲線如圖所示.下列說法正確的是( )| A. | a點:c(HA)>c(A-) | B. | b點:c(Na+)=c(A-)+c(HA) | ||
| C. | c點:c(H+)+c(HA)=c(OH-) | D. | d點:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能被銀氨溶液氧化 | |
| B. | 能使KMnO4酸性溶液褪色 | |
| C. | 1mol該有機物只能與1molBr2發生加成反應 | |
| D. | 1mol該有機物只能與1molH2發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
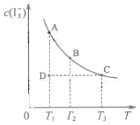 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq)某I2、KI混合溶液中,I3-的物質的量濃度c(I3-)與溫度T的關系如圖所示(曲線上任何一點都表示平衡狀態,忽略I2 的揮發).下列說法正確的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq)某I2、KI混合溶液中,I3-的物質的量濃度c(I3-)與溫度T的關系如圖所示(曲線上任何一點都表示平衡狀態,忽略I2 的揮發).下列說法正確的是( )| A. | 反應 I2(aq)+I-(aq)?I3-(aq)△H>0 | |
| B. | 狀態A與狀態B相比,狀態A的c(I2)大 | |
| C. | 若反應進行到狀態D時,一定有v逆>v正 | |
| D. | 若溫度為T1、T2,反應的平衡常數K1、K2則 K1>K2 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
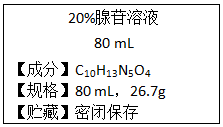 根據腺苷的相關信息,計算下列各題:
根據腺苷的相關信息,計算下列各題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com