
分析 (1)原電池反應中負極是鐵,電極反應為Fe-2e-=Fe2+;銅做正極,溶液中銅離子得到電子生成銅發生還原反應,電極反應Cu2++2e-=Cu;
(2)銅片質量增加了12.8g,轉移電子物質的量為$\frac{12.8g}{64g/mol}$×2=0.4mol,有0.2molFe反應,據此計算溶液質量變化;
(3)反應后生成0.2mol硫酸亞鐵,據c=$\frac{n}{V}$計算溶液濃度.
解答 解:(1)銅做正極,溶液中銅離子得到電子生成銅發生還原反應,電極反應Cu2++2e-=Cu,故答案為:正;Cu2++2e-=Cu;
(2)原電池中陰離子移向負極,所以硫酸根離子移向負極Fe,生成0.2molCu,有0.2molFe溶解,溶液質量減少0.2mol×64g/mol-0.2mol×56g/mol=1.6g,故答案為:鐵;1.6;
(3)反應后硫酸亞鐵的物質的量濃度為$\frac{0.2mol}{0.2L}$=1mol/L,故答案為:1mol/L.
點評 本題考查了原電池原理分析、電極反應書寫計算的應用,掌握基礎是關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
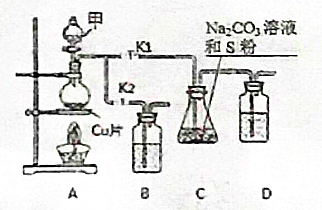 硫代硫酸鈉(Na2S2O3)在工業生產、醫藥制造業中被廣泛應用,工業普遍使用Na2SO3與硫磺(S)共煮得到,裝置如圖1.
硫代硫酸鈉(Na2S2O3)在工業生產、醫藥制造業中被廣泛應用,工業普遍使用Na2SO3與硫磺(S)共煮得到,裝置如圖1.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 羥基的電子式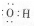 | B. | 醛基官能團符號-COH | ||
| C. | 乙醇的分子式:CH3CH2OH | D. | 異丁烷的結構簡式:CH3CH(CH3)CH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在元素周期表左下方區域的金屬元素中尋找半導體材料 | |
| B. | 利用元素周期表中氟、氯、硫、磷附近的元素研制新型農藥 | |
| C. | 在過渡金屬中尋找催化劑和耐高溫、耐腐蝕的合金材料 | |
| D. | 在周期表一定區域內尋找元素、發現物質的新用途是一種相當有效的方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 有使濕潤的pH試紙變藍的氣體產生 | |
| B. | 滴有水滴的玻璃片凍結在燒杯底部 | |
| C. | 盛有飽和硝酸鉀溶液的試管置于反應混合物內,拿出后發現溶液渾濁 | |
| D. | 燒杯外壁有水珠凝結 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. |  4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 | |
| B. |  N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 | |
| C. | 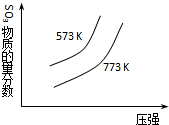 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 | |
| D. | 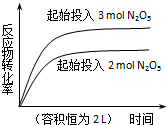 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 19 | B. | 18 | C. | 27 | D. | 9 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com