
【題目】25℃時,用相同濃度的NaOH溶液,分別滴定20mL0.1mol·L-1的三種酸(HA、HB和HD)溶液體積的變化曲線如圖所示。下列判斷正確的是( )
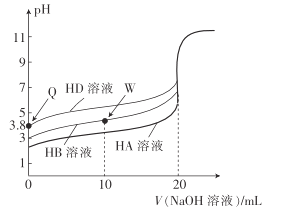
A.由Q點可知,HD的電離平衡常數Ka≈10-7.6
B.三種酸的酸性強弱:HD>HB>HA
C.滴定至W點時,溶液中存在:c(B-)>c(Na+)>c(H+)>c(OH-)
D.當三種溶液恰好完全中和后將其混合,溶液中存在:c(Na+)=c(A-)+c(B-)+c(D-)
【答案】C
【解析】
A.Q點溶液的pH=3.8,c(D-)≈c(H+)=10-3.8mol·L-1,c(HD)≈0.1mol·L-1,則HD的電離平衡常數![]() ,A錯誤;
,A錯誤;
B.根據圖象可知,沒有加堿時,0.1mol·L-1的三種酸(HA、HB和HD)溶液,pH大小為:HD>HB>HA,溶液pH越大酸性越弱,則三種酸的酸性強弱:HD<HB<HA,B錯誤;
C.W點時,加入的NaOH反應掉一半的HB,則此時溶質為等濃度的HB、NaB,HB電離出H+,B-水解產生OH-,結合圖示,可知溶液的pH<7,溶液呈酸性,則c(H+)>c(OH-),,說明HB的電離程度大于B-的水解程度,則c(B-)>c(HB)。結合物料守恒c(B-)+c(HB)=2c(Na+),可知:c(B-)>c(Na+)>c(HB),溶液中離子濃度大小為:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),C正確;
D.0.1mol·L-1的三種酸的pH都大于>1,說明三種酸都是弱酸,則完全反應后生成的都是強堿弱酸鹽,混合液呈堿性,則c(H+)<c(OH-),結合電荷守恒c(Na+)+c(H+)=c(A-)+c(B-)+c(D-)+c(OH-),可知:c(Na+)>c(A-)+c(B-)+c(D-),D錯誤。
答案選C。


科目:高中化學 來源: 題型:
【題目】有機物Z常用于治療心律失常,Z可由有機物X和Y在一定條件下反應制得,下列敘述正確的是
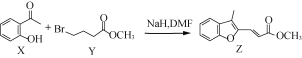
A.X中所有原子可能在同一平面內
B.X、Z均能與酸性KMnO4溶液反應
C.1 mol Y最多能與2 mol NaOH反應
D.室溫下Z與足量Br2加成產物的分子中有2個手性碳原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列分子中,各分子的空間構型、中心原子的雜化方式以及孤電子對數均正確的是
選項 | 分子 | 空間構型 | 雜化方式 | 孤電子對數 |
A | NH3 | 平面三角形 | sp3雜化 | N含有一對孤電子對 |
B | CCl4 | 正四面體 | sp3雜化 | C不含有孤電子對 |
C | H2O | V形 | sp2雜化 | O含有兩對孤電子對 |
D | CO32- | 三角錐形 | sp3雜化 | C含有一對孤電子對 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:H2(g)+F2(g)=2HF(g) △H1=-270kJmol-1。下列說法不正確的是( )
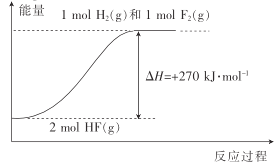
A.1molH2(g)與1molF2(g)的鍵能之和比2molHF(g)的鍵能高270kJ·mol-1
B.HF(g)分解為H2(g)與F2(g)的反應過程的能量變化可用如圖來表示
C.若反應中有20gHF(g)生成,則放出135kJ熱量
D.若H2(g)+Cl2(g)=2HCl(g) △H2=-QkJ·mol-1,則Q<270
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國是世界上最早制得和使用金屬鋅的國家,一種以閃鋅礦(ZnS,含有SiO2和少量FeS、CdS、PbS雜質)為原料制備金屬鋅的流程如圖所示,下列有關說法不正確的是( )
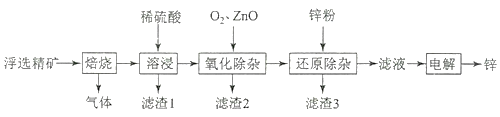
A.濾渣1的成分是SiO2 , 濾渣2的成分是Fe(OH)3
B.焙燒過程中主要反應的化學方程式為2ZnS+3O2![]() 2ZnO+2SO2
2ZnO+2SO2
C.溶液中的Cd2+可用鋅粉除去,反應的離子方程式為Zn+Cd2+=Zn2++Cd
D.若不通入氧氣,其后果是無法除去雜質Fe2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用所學知識,解決下列問題。
(1)AlCl3溶液呈___(填“酸”“中”或“堿”)性,原因是___(用離子方程式表示)。實驗室配制AlCl3溶液時,常將AlCl3固體先溶于較濃的鹽酸中,再用蒸熘水稀釋到所需的濃度,目的是___。
(2)今有常溫下五種溶液:CH3COONa溶液、NH4Cl溶液、NaOH溶液、氨水、NH4HSO4溶液。
①CH3COONa溶液pH___(填“>”“=”或“<” )7,若要使溶液的pH增大,可采取的措施是___。
②pH相等的NaOH溶液和CH3COONa溶液,分別稀釋相同倍數后,NaOH溶液的pH___(填“>”“=”“<”)CH3COONa溶液。
③物質的量濃度均為0.1mol·L-1的三種溶液:A.NH4Cl溶液 B.NH4HSO4溶液 C.氨水,c(NH4+)由大到小的順序為___(填字母)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物F(![]() )是有機合成的中間體。現以甲苯為原料合成F的路線如圖所示。
)是有機合成的中間體。現以甲苯為原料合成F的路線如圖所示。

已知:①R-CN![]() R-COOH
R-COOH
②
回答下列問題:
(1)A→B的反應試劑是___。
(2)B→C反應的化學方程式為___,反應類型是___。D→E的反應類型是___。
(3)D中含氧官能團的名稱是___。
(4)G是F的同系物,比F多一個碳原子,其苯環上含兩個取代基的同分異構體有___種(不考慮立體異構)。其中核磁共振氫譜有六組峰,且峰面積之比為1:1:1:2:2:3的有機物結構簡式為___。
(5)結合以上合成路線及相關信息,設計由苯合成苯酚的合成路線___。(用合成流程圖表示,并注明反應條件)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物結構簡式如圖,下列對該物質的敘述中正確的是

A.該有機物能發生取代反應、氧化反應和消去反應
B.1mol該有機物最多可與2molNaOH發生反應
C.該有機物可以與溴的四氯化碳溶液發生加成反應使之褪色
D.該有機物有3個手性碳原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無水MgBr2可用作催化劑,實驗室采用鎂屑與液溴為原料制備無水MgBr2,裝置如圖1。
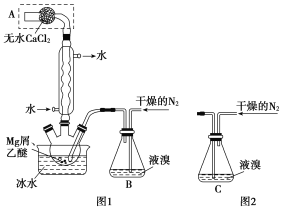
主要步驟如下:
步驟1:三頸瓶中裝入10g鎂屑和150mL無水乙醚;裝置B中加入15mL液溴。
步驟2:緩慢通入干燥的氮氣,直至溴完全導入三頸瓶中。
步驟3:反應完畢后恢復至室溫,過濾除去鎂,濾液轉移至另一干燥的燒瓶中,冷卻至0℃,析出晶體,再過濾得三乙醚合溴化鎂粗品。
步驟4:常溫下用苯溶解粗品,冷卻至0℃,析出晶體,過濾,洗滌得三乙醚合溴化鎂,加熱至160℃分解得無水MgBr2產品。
已知:①Mg和Br2反應劇烈放熱;MgBr2具有強吸水性
②MgBr2+3C2H5OC2H5→MgBr2·3C2H5OC2H5
請回答下列問題:
(1)儀器A的名稱是__。實驗中不能用干燥空氣代替干燥N2,原因是__。
(2)如將裝置B改為裝置C(圖2),可能會導致的后果是__。
(3)有關步驟4的說法,正確的是__。
A.可用95%的乙醇代替苯溶解粗品
B.洗滌晶體可選用0℃的苯
C.加熱至160℃的主要目的是除去苯
D.該步驟的目的是除去乙醚和可能殘留的溴
(4)為測定產品的純度,可用EDTA(簡寫為Y)標準溶液滴定,反應的離子方程式:Mg2++Y4-=Mg+Y2-
①滴定前潤洗滴定管的操作方法是__。
②測定前,先稱取0.2500g無水MgBr2產品,溶解后,用0.0500mol·L-1的EDTA標準溶液滴定至終點,消耗EDTA標準溶液26.50mL,則測得無水MgBr2產品的純度是__(以質量分數表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com