
| 實驗序號 | 溫度℃ | 壓強/kPa | CH4初始濃度/mol•L-1 | H2O初始濃度/mol•L-1 |
| 1 | 400 | p | 3.0 | 7.0 |
| 2 | t | 101 | 3.0 | 7.0 |
| 3 | 400 | 101 | 3.0 | 7.0 |
分析 (1)根據蓋斯定律得①+②+$\frac{1}{2}$×③甲烷和氧氣一步合成液態甲醇的熱化學方程式.
(2)①反應是吸熱反應,溫度升高,正向進行,k增大;②根據化學平衡常數k,用三段式表示平衡時的濃度,計算轉化率.
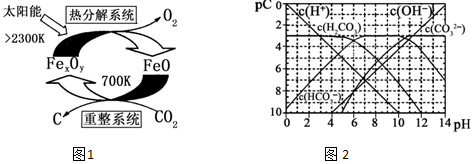
(3)①由示意圖可知,重整系統中CO2和FeO反應生成FexOy和C,根據原子守恒確定FexOy的化學式;
②熱分解系統中是FexOy分解為FeO與氧氣,根據Fe元素化合價變價計算轉移電子.
(4)①根據離子存在溶液的酸堿性判斷;
②由圖象可知當pH=6時,pC(H2CO3)=pC(HCO3-),結合Ka1(H2CO3)=$\frac{c({H}^{+})•c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$計算;
③“緩沖溶液”中加入少量的強酸或強堿,溶液的pH變化都不大,加入堿時與碳酸氫根離子反應.
解答 解:(1)有熱化學方程式:
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②2H2(g)+CO(g)?CH3OH(l)△H2=-128.3kJ•mol-1
③2H2(g)+O2(g)?2H2O (g)△H3=-483.6kJ•mol-1
根據蓋斯定律:①+②+$\frac{1}{2}$×③得CH4(g)+$\frac{1}{2}$O2 (g)?CH3OH(l)△H1=-164.0kJ•mol-1.
故答案為:CH4(g)+$\frac{1}{2}$O2 (g)?CH3OH(l)△H1=-164.0kJ•mol-1
(2)①反應一是吸熱反應,溫度升高,化學平衡正向移動,k值變大,實驗2的溫度高于實驗3,所以k2>k3
故答案為:>
②設CH4和H2O的起始量為x,根據三段式:
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量:x x 0 0
轉化量:0.1 0.1 0.1 0.3
平衡量:x-0.1 x-0.1 0.1 0.3
由平衡常數表達式k=$\frac{c(CO)•c^3(△{H}_{2})}{c(C{H}_{4})•c({H}_{2}O)}$=$\frac{0.1mol/L•(0.3mol/L)^3}{(x-0.1)mol/L•(x-0.1)mol/L}$=27,解得x=0.11,則平衡時甲烷的轉化率為:$\frac{0.1mol}{0.11mol}×100%$=90.9%.
故答案為:$\frac{10}{11}$(90.9%、90.91%、$\frac{10}{11}$×100%)
(3))①由示意圖可知,重整系統中CO2和FeO反應生成FexOy和C,發生的反應中n(FeO):n(CO2)=6:1,根據Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化學式為Fe3O4.
故答案為:Fe 3O4
②熱分解系統中是Fe3O4分解為FeO與氧氣,分解l mol Fe3O4轉移電子的物質的量為$1mol×3×(\frac{8}{3}-2)$=2mol.
故答案為:2mol
(4)①碳酸存在的溶液中酸性較強、碳酸根離子存在的溶液中堿性較強,所以碳酸根離子和碳酸不能大量共存.
故答案為:不能;
②由圖象可知當pH=6時,pC(H2CO3)=pC(HCO3-),結合Ka1(H2CO3)=$\frac{c({H}^{+})•c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=$\frac{1{0}^{-6}•c(HC{{O}_{3}}^{-)}}{c({H}_{2}C{O}_{3})}$=1×10-6.
故答案為:1×10-6
③氫離子濃度增大,平衡向左移動放出CO2,碳酸濃度基本不變,則c(H+)/c(H2CO3)最終將變大.
故答案為:A
點評 本題考查了蓋斯定律的應用,弱電解質在水溶液中的電離平衡,物質的量的相關計算,化學平衡的計算及影響因素,綜合考查,難度較大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
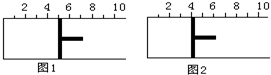 如圖所示,一定條件下將lmolA氣體和3molB氣體充入一個體積可變的密閉容器中,可滑動活塞的位置圖1所示.在恒溫恒壓下發生A(g)+3B(g)?2C(g),當反應達到平衡時,活塞位置如圖2所示,則平衡時A的轉化率為( )
如圖所示,一定條件下將lmolA氣體和3molB氣體充入一個體積可變的密閉容器中,可滑動活塞的位置圖1所示.在恒溫恒壓下發生A(g)+3B(g)?2C(g),當反應達到平衡時,活塞位置如圖2所示,則平衡時A的轉化率為( )| A. | 20% | B. | 40% | C. | 50% | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2體積SO2和足量O2反應,一定不能生成2體積SO3 | |
| B. | 其他條件不變,增大壓強,正反應速率增大逆反應速率也增大 | |
| C. | 加入2molSO2和1molO2放出的熱量是加入1molSO2和0.5molO2放出熱量的2倍 | |
| D. | 平衡后再加入1molSO3,SO2的轉化率增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸、純堿、石膏 | B. | 鹽酸、燒堿、小蘇打 | ||
| C. | 碳酸、乙醇、硫酸鈉 | D. | 磷酸、生石灰、苛性鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 純凈的液氨中,pN=7 | |
| B. | 純凈的液氨中,c(NH4+)•c(NH2-)>1.0×10-14 | |
| C. | 1 L溶解有0.001 mol NH4C1的液氨溶液,其pN=3 | |
| D. | 1 L溶解有0.001 mol NaNH2的液氨溶液,其pN=11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl2>Fe3+>I2>S | B. | Cl2>I2>Fe3+>S | C. | Cl2>Fe3+>S>I2 | D. | Fe3+>I2>C12>S |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com