
 已知A、B、C、D、E五種元素的原子序數依次遞增,A、B、C、D位于短周期.A是原子半徑最小的元素;B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同;D原子的核外成對電子數是未成對電子數的3倍;E有“生物金屬”之稱,E4+和氬原子的核外電子排布相同.A、B、D三種元素組成的一種化合物M是新裝修居室中常含有的一種有害氣體,A、B兩種元素組成的原子個數之比為1:1的化合物N是常見的有機溶劑.
已知A、B、C、D、E五種元素的原子序數依次遞增,A、B、C、D位于短周期.A是原子半徑最小的元素;B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同;D原子的核外成對電子數是未成對電子數的3倍;E有“生物金屬”之稱,E4+和氬原子的核外電子排布相同.A、B、D三種元素組成的一種化合物M是新裝修居室中常含有的一種有害氣體,A、B兩種元素組成的原子個數之比為1:1的化合物N是常見的有機溶劑. ,E的基態原子的外圍電子排布式為3d24s2.
,E的基態原子的外圍電子排布式為3d24s2.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
分析 A、B、C、D、E五種元素的原子序數依次遞增,A、B、C、D位于短周期.A是原子半徑最小的元素,則A為氫元素;B元素的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同,因此B的電子排布為1s22s22p2,即B為碳元素;D的基態原子的核外成對電子數是未成對電子數的3倍,則D的電子排布為1s22s22p4,即D為氧元素;B、C、D的原子序數依次遞增,因此C為N元素.A、B、D三種元素組成的一種化合物M是新裝修居室中常含有的一種有害氣體,因此M是甲醛.A、B兩種元素組成的原子個數之比為1:1的化合物N是常見的有機溶劑,則N是苯.E有“生物金屬”之稱,E4+和氬原子的核外電子排布相同,則E的原子序數為18+4=22,即E為鈦元素.
解答 解:A、B、C、D、E五種元素的原子序數依次遞增,A、B、C、D位于短周期.A是原子半徑最小的元素,則A為氫元素;B元素的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同,因此B的電子排布為1s22s22p2,即B為碳元素;D的基態原子的核外成對電子數是未成對電子數的3倍,則D的電子排布為1s22s22p4,即D為氧元素;B,、C、D的原子序數依次遞增,因此C為N元素.A、B、D三種元素組成的一種化合物M是新裝修居室中常含有的一種有害氣體,因此M是甲醛.A、B兩種元素組成的原子個數之比為1:1的化合物N是常見的有機溶劑,則N是苯.E有“生物金屬”之稱,E4+和氬原子的核外電子排布相同,則E的原子序數為18+4=22,即E為鈦元素.
(1)A2D2分子是H2O2,含有極性鍵和非極性鍵的共價化合物,其電子式為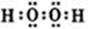 ;Ti的原子序數為22,根據構造原理可知,其電子基態電子排布為1s22s22p63s23p63d24s2,電子最后填充3d電子,則外圍電子排布為3d24s2,
;Ti的原子序數為22,根據構造原理可知,其電子基態電子排布為1s22s22p63s23p63d24s2,電子最后填充3d電子,則外圍電子排布為3d24s2,
故答案為: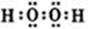 ;3d24s2;
;3d24s2;
(2)B、C、D三種元素分別為C、N、O,同周期第一電離能自左而右具有增大趨勢,所以第一電離能O>C.由于氮元素原子2p能級有3個電子,處于半滿穩定狀態,能量較低,第一電離能大于相鄰元素,所以B、C、D三種元素的第一電離能數值由小到大的順序為C<O<N,
故答案為:C<O<N;
(3)氮元素的最高價氧化物是硝酸,具有強氧化性,在加熱的條件下濃硝酸能氧化單質碳,反應的化學方程式是:C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案為:C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)a.甲醛是平面型結構,但由于甲醛分子中共價鍵的極性不能抵消,所以甲醛是極性分子,而苯是平面正六邊形結構,屬于非極性分子,故a正確;
b.化合物M為甲醛,碳原子的孤電子對數為0,碳原子的σ鍵數為3,則碳原子采取sp2雜化.CO2是直線型結構,碳原子是sp雜化,故b錯誤;
c.苯分子中的碳碳鍵介于碳碳單鍵和碳碳雙鍵之間的一種獨特的鍵,所以苯分子中含有12個σ鍵和1個大π鍵,故c錯誤;
d.CO2形成晶體類型是分子晶體,而二氧化硅是原子晶體,所以CO2晶體的熔點、沸點都比二氧化硅晶體的低,故d正確,
故選:ad;
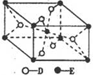
(5)根據晶胞的結構可知,晶胞中含有Ti原子的個數=1+8×$\frac{1}{8}$=2,氧原子個數=2+4×$\frac{1}{2}$=4,所以Q的化學式是TiO2.根據蓋斯定律可知,①+②即得到反應TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g),所以該反應的反應熱△H=+140kJ/mol-221kJ/mol=-81kJ/mol,
反應熱化學方程式為:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol,
故答案為:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol;
(6)①合成氨反應是放熱反應,所以升高溫度平衡向逆反應方向移動,因此平衡常數減小,即K1>K2,
故答案為:>;
②當測得CA3和C2、A2的物質的量分別為3mol和1 mol、2 mol時,它們的濃度分別是6mol/L、2mol/L、4mol/L,則根據平衡常數表達式可知,此時$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2})×c({N}_{2})}$=$\frac{{6}^{2}}{{4}^{3}×2}$=$\frac{9}{32}$<0.5,所以反應向正反應方向移動,即氮氣正反應速率大于氮氣逆反應速率,
故答案為:>.
點評 本題考查元素周期表的結構和元素周期律的應用、核外電子排布、第一電離能、分子的空間構型、化學鍵以及晶體的有關判斷和計算、反應熱的計算、平衡常數的應用和外界條件對平衡狀態的影響等,題目比較綜合,是對學生綜合能力的考查,難度中等.


 全能測控期末小狀元系列答案
全能測控期末小狀元系列答案科目:高中化學 來源: 題型:選擇題
| A. | 用明礬對自來水進行殺菌消毒 | |
| B. | 鈉長期放置在空氣中,最終將變成碳酸氫鈉 | |
| C. | CCl4、Cl2及HF中的原子都滿足最外層8電子穩定結構 | |
| D. | 質子數為53、中子數為78的碘原子:${\;}_{53}^{131}$I |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
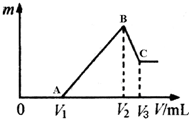 將0.1mol的鎂、鋁混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.請回答:
將0.1mol的鎂、鋁混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳酸氫銨和硝酸銨 | B. | 碳酸銨和硝酸銨 | ||
| C. | 碳酸氫銨和氯化銨 | D. | 碳酸銨和氯化銨 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 有$\frac{1}{2}$NA個硫原子被還原 | B. | 有$\frac{1}{3}$NA個氮原子被氧化 | ||
| C. | 有$\frac{3}{4}$NA個二氧化硫分子生成 | D. | 有$\frac{2}{3}$NA個硫酸銨分解 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解精煉銅的過程中,每轉移NA個電子時,陽極溶解銅的質量為32g | |
| B. | 一定條件下6.4gS02與足量氧氣反應生成S03,轉移電子數小于0.2NA | |
| C. | lmol羥基(一OH)與17gNH3所含電子數都為NA | |
| D. | 適量銅粉溶解于1 L0.5mol/L稀硝酸中,當生成2.24LNO時,溶液中氮原子數0.4NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氨氣通入醋酸溶液CH3COOH+NH3═CH3COONH4 | |
| B. | 澄清的石灰水跟鹽酸反應H++OH-═H2O | |
| C. | 碳酸鋇溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金屬鈉跟水反應Na+H2O═Na ++OH-+H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②⑤ | B. | ①③⑥ | C. | ②④⑤ | D. | ①②④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com