
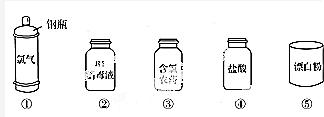
分析 (1)氯氣有毒;
(2)漂白粉的主要成分為Ca(ClO)2、CaCl2,有效成分是Ca(ClO)2,漂白液的有效成分為NaClO;
(3)氫氣與氯氣反應生成HCl,溶于水得到鹽酸;氯水中HClO不穩定,若變質生成鹽酸,酸性增強;
(4)MnO2完全反應,根據n=$\frac{m}{M}$計算8.7g的MnO2的物質的量,再根據方程式計算氯氣的體積.
解答 解:(1)氯氣為有毒的氣體,則①中鋼瓶上應貼的標簽為C,不易燃、易爆,本身不具有腐蝕性,故答案為:C;
(2)A.漂白粉的主要成分為Ca(ClO)2、CaCl2,漂白液的有效成分為NaClO,均為混合物,故A錯誤;
B.漂白粉的有效成分是Ca(ClO)2,含ClO-具有強氧化性,可用于漂白,故B正確;
C.石灰水的濃度較小,工業上將氯氣通入石灰乳中制取漂白粉,故C錯誤;
D.漂白液由氫氧化鈉和氯氣反應生成,有效成分是NaClO,故D正確;
故答案為:BD;
(3)氫氣與氯氣反應生成HCl,溶于水得到鹽酸,發生的反應為H2+Cl2$\frac{\underline{\;點燃\;}}{\;}$2HCl;氯水中HClO不穩定,若變質生成鹽酸,酸性增強,可選紫色石蕊檢驗,氯水、鹽酸與A、B、C混合的現象均相同,不能鑒別,故答案為:Cl2+H2$\frac{\underline{\;點燃\;}}{\;}$2HCl;D;
(4)8.7g的MnO2的物質的量=$\frac{8.7g}{87g/mol}$=0.1mol,則:
MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1mol 22.4L
0.1mol V
V=$\frac{0.1mol×22.4L/mol}{1mol}$=2.24L;
故答案為:2.24.
點評 本題考查較綜合,涉及物質的性質、氧化還原反應計算等,注重高頻考點的考查,把握氯氣的性質、氯水的成分及物質性質與用途的關系等為解答的關鍵,側重分析、應用及計算能力的考查,題目難度不大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
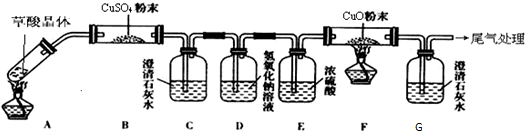
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 30mL | B. | 40mL | C. | 50mL | D. | 60mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
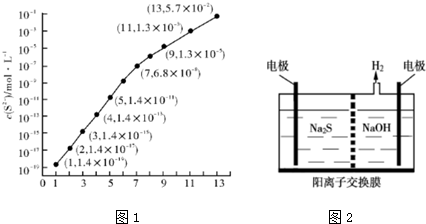
| Ka | Ka2 | |
| H2S03 | 1.3×10-2 | 6.3×10-8 |
| H2C03 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
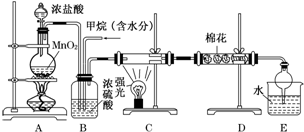
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SiO2(CaO):HCl | B. | MgO(Al2O3):NaOH | C. | CO2(SO2):Ca(OH)2 | D. | NaCl(NH4Cl):加熱 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com