
| A. | 錫制器皿長期處于低于13.2℃的環境中,會自行毀壞 | |
| B. | 錫在常溫下以灰錫狀態存在 | |
| C. | 灰錫轉化為白錫的反應是放熱反應 | |
| D. | 灰錫和白錫的相互轉化互為可逆反應 |
分析 A.由Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)可知,溫度低于13.2°C時,白錫轉化為灰錫;
B.由Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)可知,溫度高于13.2°C時,以白錫狀態存在;
C.灰錫轉化為白錫的反應△H>0,灰錫轉化為白錫的反應是吸熱反應;
D.可逆反應要求正、逆反應在相同條件下進行.
解答 解:A.由Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)可知,溫度低于13.2°C時,白錫轉化為灰錫,灰錫以粉末狀存在,故A正確;
B.由Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)可知,溫度高于13.2°C時,以白錫狀態存在,常溫下高于13.2°C,因此常溫下以白錫存在,故B錯誤;
C.由Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)△H=+2.1kJ/mol可知,灰錫轉化為白錫的反應是吸熱反應,故C錯誤;
D.灰錫和白錫的相互轉化不是在相同條件下進行的,因此不是可逆反應,故D錯誤;
故選A.
點評 本題考查學生蓋斯定律的應用以及物質的能量和其穩定性之間的關系,可以根據所學知識進行回答,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 分子中的C、H、O的個數比為1:2:3 | B. | 分子中C、H個數比為1:2 | ||
| C. | 該有機物的相對分子質量為14 | D. | 該分子中肯定不含氧元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
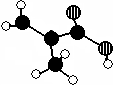 化工廠生產的某產品只含C、H、O三種元素,分子模型如圖所示(圖中球與球之間的連線代表化學鍵,如單鍵、雙鍵等).
化工廠生產的某產品只含C、H、O三種元素,分子模型如圖所示(圖中球與球之間的連線代表化學鍵,如單鍵、雙鍵等).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素 電離能/kJ•mol-1 | X | Y | Z |
| I1 | 496 | 738 | 577 |
| I2 | 4 562 | 1 451 | 1 817 |
| I3 | 6 912 | 7 733 | 2 754 |
| I4 | 9 540 | 10 540 | 11 578 |
| A. | 三種元素中,X元素的第一電離能最小,其電負性在同一周期元素中也最小 | |
| B. | 三種元素中,Y元素的第一電離能最大,其電負性也最大 | |
| C. | 等物質的量的X、Y、Z三種單質與少量鹽酸反應時放出的氫氣的物質的量之比為1:1:1 | |
| D. | 三種單質與鹽酸反應放出等量氫氣時,消耗X、Y、Z的物質的量之比為3:2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{15}^{30}P$→${\;}_{14}^{30}Si$+x | B. | ${\;}_{7}^{14}N{+}_{0}^{1}n$→${\;}_{6}^{14}C$+x | ||
| C. | ${\;}_{27}^{60}Co$→${\;}_{28}^{60}Ni$+x | D. | ${\;}_{13}^{27}Al{+}_{2}^{4}He$→${\;}_{15}^{30}P$+x |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
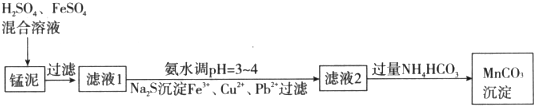
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | IA族,單質的熔點逐漸降低 | |
| B. | ⅥA族,對氣態氫化物還原性逐漸增強 | |
| C. | VA族氫化物的沸點逐漸升高 | |
| D. | ⅣA族最高氧化物對應水化物的酸性逐漸增強 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com