
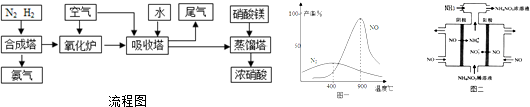
分析 工業制硝酸的流程圖分析:1、在合成塔中,N2與H2化合生成NH3.2、在氧化爐里,NH3與空氣中的O2反應,被氧化成NO、NO2.3、在吸收塔中,氧化爐中產生的NO、NO2氣體與空氣中的O2、通入的H2O反應生成硝酸.4、在蒸餾塔中,從吸收塔中過來硝酸中加入硝酸鎂,進行濃縮處理,從而制得濃硝酸.
解答 解:(1)吸收塔主要吸收二氧化氮生成硝酸.另外從氧化爐里過來的氣體中有NO,通入空氣,可以將NO氧化為NO2,然后再與NO2、H2O反應生成HNO3;加入硝酸鎂的作用是吸收水,而且不與硝酸反應,從而達到濃縮的目的.可以用濃硫酸來代替,既可以吸收水分,不易揮發,也不與硝酸反應.
故答案為:將NO、NO2等氧化為硝酸;A;
(2)由反應物和產物及質量守恒定律可知發生的反應為NO+NO2+H2O=2HNO2、CO(NH2)2+2HNO2═CO2↑+2N2↑+3H2O,
故答案為:NO+NO2+H2O=2HNO2;CO(NH2)2+2HNO2═CO2↑+2N2↑+3H2O;
(3)由所給圖表,發現在800~900℃時,主產物NO的產率很高,而副產物N2的產率很低,
故答案為:800~900℃時副產物N2的產率較低,NO的產率很高;
(4)電解NO制備NH4NO3,陽極反應為NO-3e-+2H2O=NO3-+4H+,陰極反應為NO+5e-+6H+=NH4++H2O,從兩極反應可看出,要使得失電子守恒,陽極產生的NO3-的物質的量大于陰極產生的NH4+的物質的量,總反應方程式為:8NO+7H2O$\frac{\underline{\;電解\;}}{\;}$3NH4NO3+2HNO3,因此要使電解產物全部轉化為NH4NO3,需補充NH3.
故答案為:8NO+7H2O$\frac{\underline{\;電解\;}}{\;}$3NH4NO3+2HNO3;將電解過程中生成的硝酸轉化為硝酸銨;
(5)根據達到平衡時,c(NO2)=0.0400mol/L,c(N2O4)=0.0100mol/L,故5L混合氣體中的NO2的物質的量n=CV=0.04mol/L×5L=0.2mol,
N2O4的物質的量n=CV=0.01mol/L×5L=0.05mol.
設反應物銅的物質的量為xmol,根據銅與濃硝酸反應時得失電子數守恒,即銅失去的電子的物質的量等于硝酸得到的電子的物質的量,可得:
2x=0.2mol×1+0.05mol×2
解得x=0.15mol
而Cu~Cu(NO3)2•3H2O,故生成的Cu(NO3)2•3H2O的物質的量為0.15mol,故質量m=nM=0.15mol×242g/mol=36.3g,
故答案為:36.3.
點評 本題考查了工業合成氨與制備硝酸、化學方程式的書寫、電解原理的應用、守恒方法在化學計算中的應用的知識,題目綜合性較強,難度中等,側重于考查學生的分析能力和計算能力、以及對基礎知識的綜合應用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:多選題
| A. | FeS+濃HNO3 | B. | Cu+濃HNO3 | C. | FeO+HNO3 | D. | Fe2O3+HNO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯酚有一定毒性,不能用作消毒劑和防腐劑 | |
| B. | 制作航天服的聚酯纖維和用于光纜通信的光導纖維都是新型無機非金屬材料 | |
| C. | 乙醇和乙酸都是常用調味品的主要成分 | |
| D. | 油脂是人體需要的重要的營養成分,屬于天然高分子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
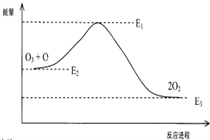
| A. | △H=△H1+△H2 | |
| B. | ClO中含有極性共價鍵 | |
| C. | 反應O3+O→2O2的△H=E1-E3 | |
| D. | 氯原子改變了該反應的歷程,但不影響△H |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
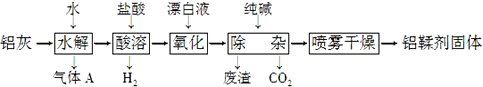
| A. | 氣體A能使濕潤的紅色石蕊試紙變藍 | |
| B. | “水解”采用90℃而不在室溫下進行的原因是加快AlN的水解和使氨氣溢出 | |
| C. | “廢渣”成分為Al(OH)3和Fe(OH)3 | |
| D. | 采用噴霧干燥而不用蒸發的原因是防止Al(OH)2Cl水解 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②④⑥ | B. | ①③ | C. | ②④⑤⑥ | D. | ③⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com