
分析 (1)根據氧化還原反應中得失電子相等來配平方程式,1mol高錳酸根離子參加氧化還原反應得到5mol電子,1mol亞硫酸氫根離子參加氧化還原反應失去2mol電子;
(2)根據高錳酸鉀和亞硫酸氫鈉之間的關系式計算亞硫酸氫鈉的物質的量濃度;
(3)根據c(待測)=$\frac{c(標注)×V(標準)}{V(待測)}$分析不當操作對V(標準)的影響,以此判斷濃度的誤差.
解答 解:(1)1mol高錳酸根離子參加氧化還原反應得到5mol電子,1mol亞硫酸氫根離子參加氧化還原反應失去2mol電子,所以得失電子的最小公倍數是10,則高錳酸根離子的計量數是2,亞硫酸氫根離子的計量數是5,其它原子根據原子守恒來配平,所以該方程式為:2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O,
故答案為:2,5,1,2,5,3;
(2)設亞硫酸氫鈉的物質的量濃度為xmol/L.
2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O.
2mol 5mol
0.0016mol 0.02xmol 解得:x=O.2000
故答案為:0.2000;
(3)A.酸式滴定管水洗后未用待測液潤洗,會導致酸性高錳酸鉀濃度偏小,需要高錳酸鉀體積偏大,即造成V(標準)偏大,測定值偏大,故A正確;
B.盛裝未知液的錐形瓶用蒸餾水洗過,未用待測液潤洗,待測液的物質的量不變,標準液的體積不變,c(待測)無影響,故B錯誤;
C.定管尖嘴部分有氣泡,滴定后消失,會導致測定高錳酸鉀體積偏大,即造成V(標準)偏大,測定值偏大,故C正確;
D.不小心將少量酸性KMnO4溶液滴在錐形瓶外,造成V(標準)偏大,根據c(待測)=$\frac{c(標注)×V(標準)}{V(待測)}$,c(待測)偏大,故D正確;
E.滴定前仰視,滴定后俯視,造成V(標準)偏小,根據c(待測)=$\frac{c(標注)×V(標準)}{V(待測)}$分析,c(待測)偏小,故E錯誤;
故答案為:ACD.
點評 本題考查了氧化還原反應的配平、物質的量的有關計算、滴定誤差分析等知識點,根據氧化還原反應中得失電子數相等來配平即可,注意誤差分析的方法,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 采取低碳、節儉的生活方式,深入農村和社區宣傳環保知識 | |
| B. | 用活性炭為糖漿脫色和用次氯酸鹽漂白紙漿的原理相同 | |
| C. | 熱純堿可以去油污,明礬可以凈化水,漂白粉可用于漂白織物 | |
| D. | 海水淡化的方法有蒸餾法、電滲析法等 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 物質 | CH3OH | CH3OCH3 | H2O |
| 濃度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S(g)+O2(g)═SO2(g)△H<-297.3kJ•mol-1 | |
| B. | 2SO2(g)═2S(s)+2O2(g)△H=+297.3kJ•mol-1 | |
| C. | 1molSO2的鍵能總和小于1molS和1molO2的鍵能總和 | |
| D. | 1molSO2具有的總能量大于1molS和1molO2的總能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
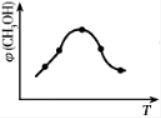
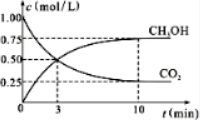
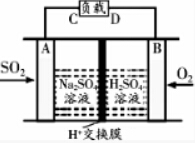
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ•mol-1,則氫氣的燃燒熱為241.8 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金剛石,s);△H=+1.9 kJ•mol-1,則石墨比金剛石穩定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3 kJ•mol-1,則含1mol NaOH的稀溶液與1mol的稀醋酸完全中和,放出的熱量也等于57.3kJ | |
| D. | 已知2C(s)+2O2(g)═2CO2(g))△H=a kJ•mol-1、2C(s)+O2(g)═2CO(g)△H=b kJ•mol-1,則a>b |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com