
分析 生成的氣體為二氧化碳,根據碳原子守恒可計算出碳酸鈉的物質的量,再根據m=nM碳酸鈉的質量,從而可知混合物中氯化鈉的質量,然后根據n=$\frac{m}{M}$、c=$\frac{n}{V}$計算出氯化鈉的濃度.
解答 解:生成的白色沉淀為碳酸鈣,碳酸鈣與稀硝酸反應生成二氧化碳氣體,根據碳原子守恒可知:n(Na2CO3)=n(CaCO3)=n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,
則原混合物中碳酸鈉的質量為:106g/mol×0.1mol=10.6g,
所以混合物中氯化鈉的物質的量為:n(NaCl)=$\frac{22.3g-10.6g}{58.5g/mol}$=0.2mol,
原混合溶液中NaCl的物質的量濃度為:c(NaCl)=$\frac{0.2mol}{0.5L}$=0.4mol/L,
答:原混合溶液中NaCl的物質的量濃度為0.4mol/L.
點評 本題考查了混合物反應的計算、物質的量濃度的計算,題目難度中等,明確發生反應的原理為解答關鍵,注意掌握守恒思想在化學計算中的應用方法,試題培養了學生的化學計算能力.


 互動課堂系列答案
互動課堂系列答案 激活思維智能訓練課時導學練系列答案
激活思維智能訓練課時導學練系列答案科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3 | B. | NaHCO3 | ||
| C. | Na2CO3和NaHCO3 | D. | NaOH、Na2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.3 mol•L-1 K2SO4溶液中含有0.6NA個K+和0.3 mol的SO42- | |
| B. | 在標準狀況下H2O的摩爾體積約是22.4 L•mol-1 | |
| C. | 將58.5g的NaCl固體溶解在1L的水中,所得的溶液物質的量濃度為1mol/L | |
| D. | 1 mol任何氣體在標準狀況下的體積都約為22.4 L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | M:N2 X:O2 | B. | M:HNO3 X:Fe | C. | M:S X:O2 | D. | M:NO X:O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
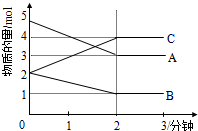 (1)某可逆反應(ABC均為氣體)從0-2分鐘進行過程中,在不同反應時間各物質的量的變化情況如圖所示.
(1)某可逆反應(ABC均為氣體)從0-2分鐘進行過程中,在不同反應時間各物質的量的變化情況如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

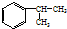 ,A的含有苯環的同分異構體(除A外)有7種,其中核磁共振氫譜顯示為2組峰,且峰面積比為3:1的同分異構體是
,A的含有苯環的同分異構體(除A外)有7種,其中核磁共振氫譜顯示為2組峰,且峰面積比為3:1的同分異構體是 (寫結構簡式).
(寫結構簡式). +nHCHO$→_{△}^{催化劑}$
+nHCHO$→_{△}^{催化劑}$ +nH2O.
+nH2O. G:
G: .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
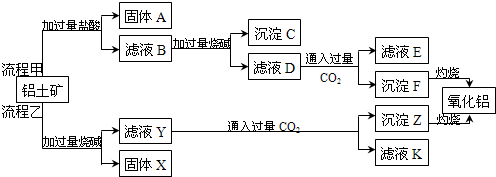
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com