
 把在空氣中久置的鋁片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的燒杯中,該鋁片與硫酸反應產生氫氣的速率與反應時間(單位:秒)的關系可用如圖曲線來表示,回答下列問題:
把在空氣中久置的鋁片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的燒杯中,該鋁片與硫酸反應產生氫氣的速率與反應時間(單位:秒)的關系可用如圖曲線來表示,回答下列問題:分析 (1)鋁是活潑性較強的金屬,能迅速和空氣中的氧氣反應生成氧化鋁,根據氧化鋁的性質分析;
(2)金屬和酸的反應是放熱反應,溫度升高是影響反應速率的主要因素,根據溫度對化學反應速率的影響分析,溶液的濃度是影響化學反應速率的主要因素;
(3)據化學方程式可知,硫酸與氫氣化學計量數相同,v(H2SO4)=v(H2),據此分析;
(4)減緩反應速率,可降低濃度、溫度,不影響生成氫氣的總量,則氫離子的物質的量不變,以此解答;
(5)催化劑加快反應速率,不影響氫氣的產量.
解答 解:(1)鋁是活潑性較強的金屬,能迅速和空氣中的氧氣反應生成氧化鋁,氧化鋁首先稀硫酸反應生成氯化鋁和水,不產生H2,化學方程式為2Al+3H2SO4=Al2(SO4)3+3H2↑故答案為:2Al+3H2SO4=Al2(SO4)3+3H2↑;
(2)金屬和酸的反應是放熱反應,使溶液的溫度升高,溫度升高是影響反應速率的主要因素,化學反應速率加快,隨著反應的進行,溶液中的氫離子濃度逐漸降低,氫離子濃度是影響化學反應速率的主要因素,所以反應速率逐漸減小,
故答案為:該反應放熱,c點前溫度對反應速率的影響大于濃度對反應速率的影響,c點后濃度對反應速率的影響較大;
(3)據化學方程式可知,硫酸與氫氣化學計量數相同,v(H2SO4)=v(H2)=$\frac{V}{11.2(b-c)}$,故答案為:$\frac{V}{11.2(b-c)}$;
(4)減緩反應速率,可降低濃度、溫度,不影響生成氫氣的總量,則氫離子的物質的量不變,①加NaOH固體能夠反應氫離子,氫離子物質的量減少;②加適量BaCl2溶液相當于加水稀釋;③加KNO3溶液,生成硝酸,不生成氫氣;④加適量H2O,氫離子濃度減小;⑤將鎂條換成鎂粉,加快反應速率;⑥加小蘇打溶液,能夠反應氫離子,氫離子物質的量減少;⑦加少量CuSO4溶液,形成原電池,反應速率加快;則符合要求的有②③④⑧,
故答案為:②③④⑧;
(5)催化劑加快反應速率,不影響氫氣的產量,
故答案為:不會.
點評 本題考查了化學反應速率的影響因素以及反應速率的計算,難度不大,注意根據圖象分析理解隨反應進行影響反應速率的主導元素.


 考前必練系列答案
考前必練系列答案科目:高中化學 來源: 題型:選擇題
| A. | “四中子”不顯電性 | |
| B. | “四中子”的質量數為4,其質量比氫原子大 | |
| C. | “零號元素”在元素周期表中與氫元素占同一位置 | |
| D. | 第二種粒子的化學式為O4,與O2互為同素異形體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 運動員服用興奮劑是違背人文道德的.某種興奮劑的結構簡式如下圖所示,有關該物質的說法錯誤的是( )
運動員服用興奮劑是違背人文道德的.某種興奮劑的結構簡式如下圖所示,有關該物質的說法錯誤的是( )| A. | 滴入KMnO4(H+)溶液,觀察到紫色褪去 | |
| B. | 該分子中的所有碳原子可能共平面 | |
| C. | 1 mol該物質與濃溴水和H2反應最多消耗Br2和H2分別為4 mol、7 mol | |
| D. | 遇FeCl3溶液不顯顏色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬元素和非金屬元素間形成的化學鍵一定是離子鍵 | |
| B. | 伴有能量變化的物質變化不一定是化學變化 | |
| C. | 可逆反應達到化學平衡時,正逆反應速率都為0 | |
| D. | 通過化學變化可以實現1H與2H間的相互轉化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子式是C3H8O3 | |
| B. | A催化氧化的產物能發生銀鏡反應 | |
| C. | 0.1 mol A與足量Na反應產生2.24 L H2(標準狀況) | |
| D. | A在一定條件下發生縮聚反應的產物是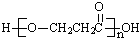 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com