
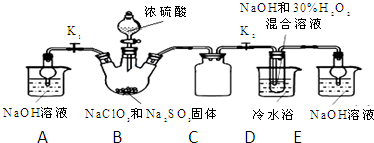
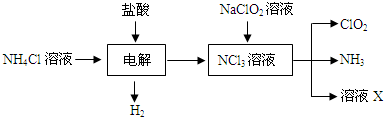
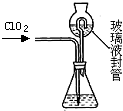
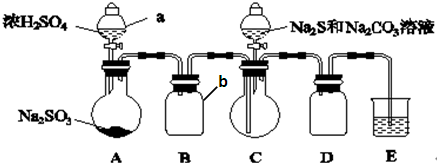
分析 (1)根據儀器用途選取儀器;
(2)裝置C的作用是安全瓶,有防倒吸作用;
(3)裝置B中制備得到ClO2,所以B中反應為NaClO3和Na2SO3在濃H2SO4的作用生成 ClO2和Na2SO4,二氧化氯和氫氧化鈉反應生成NaClO2;
(4)由題目信息可知,應控制溫度38℃~60℃,高于60℃時NaClO2分解成NaClO3和NaCl;
(5)從裝置D的溶液獲得NaClO2晶體,需要蒸發結晶、趁熱過濾、洗滌、干燥;
(6)B中可能發生Na2SO3+H2SO4(濃)=Na2SO4+SO2↑+H2O,產生的SO2 被帶入D中,SO2與H2O2 反應生成硫酸鈉;
(7)①碘遇淀粉變藍色,反應結束時,碘反應完全,滴加最后一滴Na2S2O3標準液時溶液藍色恰好褪去且半分鐘內不復原,說明到達滴定終點;
②根據化學反應可得關系式:NaClO2~2I2~4S2O32-,令樣品中NaClO2的物質的量x,根據關系式計算.
解答 解:(1)用50%雙氧水配制30%的H2O2溶液,需要的儀器有量筒、燒杯、玻璃棒、膠體滴管,所以還需要量筒,故答案為:量筒;
(2)裝置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,故答案為:防止D瓶溶液倒吸到B瓶中(或安全瓶);
(3)裝置B中制備得到ClO2,所以B中反應為NaClO3和Na2SO3在濃H2SO4的作用生成 ClO2和Na2SO4,反應的方程式為2NaClO3+Na2SO3+H2SO4=2 ClO2↑+2Na2SO4+H2O,二氧化氯和雙氧水、氫氧化鈉反應生成NaClO2,反應方程式為2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O,
故答案為:2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O;
(4)由題目信息可知,應控制溫度38℃~60℃,高于60℃時NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能導致產品中混有的雜質是NaClO3和NaCl,
故答案為:NaClO3和NaCl;
(5)從裝置D的溶液獲得NaClO2晶體,需要蒸發結晶、趁熱過濾、洗滌、干燥操作,所以第iii操作是用45℃左右的熱水洗滌3遍(熱水溫度高于38℃,低于60℃),故答案為:用45℃左右的熱水洗滌3遍(熱水溫度高于38℃,低于60℃);
(6)B中可能發生Na2SO3+H2SO4(濃)=Na2SO4+SO2↑+H2O,產生的SO2 被帶入D中,SO2與H2O2 反應生成硫酸鈉,濃硫酸難揮發,硫酸鈉是難揮發的鹽,不會進入D,故a正確,b、c錯誤,故選:a;
(7)①碘遇淀粉變藍色,反應結束時,碘反應完全,滴加最后一滴Na2S2O3標準液時溶液藍色恰好褪去且半分鐘內不復原,說明到達滴定終點,
故答案為:滴加最后一滴Na2S2O3標準液時,溶液藍色恰好褪去且半分鐘內不復原,說明到達滴定終點;
②令樣品中NaClO2的物質的量x,則:
NaClO2~2I2~4S2O32-,
1mol 4mol
0.25x c mol•L-1×V×10-3L
故x=c•V•10-3mol,
故答案為:c•V•10-3.
點評 本題考查亞氯酸鈉制備實驗的基本操作、亞氯酸鈉的性質及中和滴定等知識,理解原理是解題的關鍵,同時考查學生分析問題、解決問題的能力,難點是流程圖的分析,題目難度中等.


科目:高中化學 來源: 題型:解答題


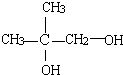 .
.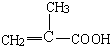 .
.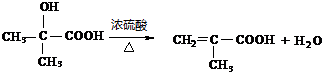
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
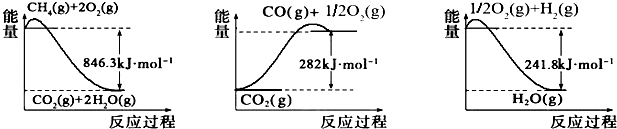
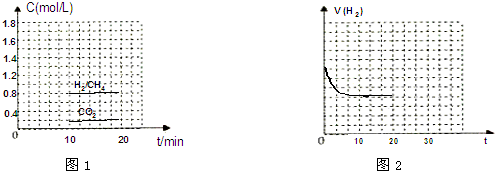
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將20g硝酸鈉和17g氯化鉀放入100ml燒杯中,加35mL水,并加熱、攪拌,使溶液濃縮至約為原來的一半時,趁熱過濾即可得到硝酸鉀晶體 | |
| B. | 焰色反應實驗中,鉑絲在蘸取待測溶液前,應先用稀硫酸洗凈并灼燒 | |
| C. | 中和滴定實驗中,如用于盛放待測溶液的錐形瓶洗凈后未干燥,不影響測定結果 | |
| D. | 移液管取液后,將移液管垂直伸入容器里面,松開食指使溶液全部流出,數秒后,取出移液管 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在氧化還原反應中,非金屬單質一定是氧化劑 | |
| B. | 還原劑在反應中發生還原反應 | |
| C. | 氧化還原反應的本質是電子的轉移 | |
| D. | 有單質生成的反應一定是氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 8.96L | B. | 6.72L | C. | 5.6L | D. | 4.48L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com