
| A. | 將20g硝酸鈉和17g氯化鉀放入100ml燒杯中,加35mL水,并加熱、攪拌,使溶液濃縮至約為原來的一半時,趁熱過濾即可得到硝酸鉀晶體 | |
| B. | 焰色反應實驗中,鉑絲在蘸取待測溶液前,應先用稀硫酸洗凈并灼燒 | |
| C. | 中和滴定實驗中,如用于盛放待測溶液的錐形瓶洗凈后未干燥,不影響測定結果 | |
| D. | 移液管取液后,將移液管垂直伸入容器里面,松開食指使溶液全部流出,數秒后,取出移液管 |
分析 A.加熱時,硝酸鉀的溶解度增大,應冷卻結晶得到硝酸鉀;
B.硫酸不揮發,干擾實驗;
C.錐形瓶洗凈后未干燥,不影響待測液中溶質的物質的量;
D.移液管取液后,應垂直放入稍傾斜的容器中,管尖與容器壁接觸,放松食指,使液體自由流出,流完后再等15秒,取出移液管.
解答 解:A.加熱時,硝酸鉀的溶解度增大,但二者溶解度受溫度影響不同,則趁熱過濾得到NaCl,冷卻結晶得到硝酸鉀,故A錯誤;
B.硫酸不揮發,干擾實驗,應選鹽酸洗凈并灼燒,故B錯誤;
C.錐形瓶洗凈后未干燥,不影響待測液中溶質的物質的量,則不影響測定結果,故C正確;
D.移液管取液后,將移液管移入準備接受溶液的容器中,使其出口尖端接觸器壁,使容器微傾斜,而使移液管直立,然后放松右手食指,使溶液自由地順壁流下,待溶液停止流出后,一般等待15秒鐘拿出,故D錯誤;
故選C.
點評 本題考查化學實驗方案的評價,為高頻考點,涉及實驗基本操作、焰色反應、中和滴定等,把握物質的性質、反應原理為解答的關鍵,側重分析與實驗能力的考查,注意實驗的評價性分析,題目難度不大.


科目:高中化學 來源: 題型:多選題
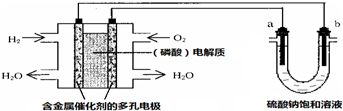
| A. | 電池工作時,正極反應式為:O2+4H++4e-═2H2O | |
| B. | 電解時,當陰極逸出amol氣體,同時有W克Na2SO4﹒10H2O 析出,保持溫度不變,剩余溶液中的硫酸鈉的質量分數是$\frac{71W}{161(W+36a)}$×100% | |
| C. | 電解時,電子流動路徑是:負極→外電路→陰極→溶液→陽極→正極 | |
| D. | 忽略能量損耗,當電池中消耗0.01g O2時,b 極周圍會產生0.02g H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 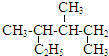 的系統命名是3,4-二甲基己烷 的系統命名是3,4-二甲基己烷 | |
| B. | 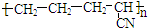 是有單體CH2=CH-CH3和CH2=CN發生加聚反應而得到的 是有單體CH2=CH-CH3和CH2=CN發生加聚反應而得到的 | |
| C. | 等質量的甲醛和乳酸[CH3CH(OH)COOH]完全燃燒消耗的氧氣不相等,但生成水的質量相等 | |
| D. | 分析反應: ,由于該反應生成了不飽和化合物(含碳氧雙鍵)和小分子,因此該反應屬于消去反應 ,由于該反應生成了不飽和化合物(含碳氧雙鍵)和小分子,因此該反應屬于消去反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
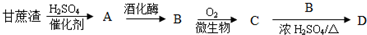
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
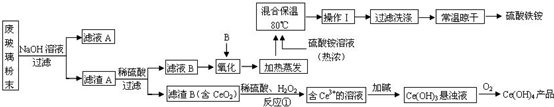

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
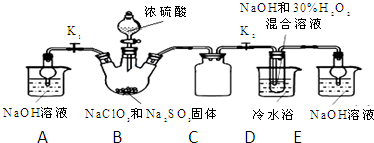
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 操作 | 現象 | 結論 | |
| A | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振蕩、靜置 | 上層溶液顯橙紅色 | 原溶液中有Br- |
| C | 用潔凈鐵絲蘸取溶液進行焰色反應 | 火焰呈紫色 | 原溶液中有K+ |
| D | 滴加NaOH溶液,加熱,將濕潤紅色石蕊試紙置于試管口 | 試紙不變藍 | 原溶液中無NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
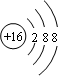 ,32g甲在足量濃硝酸中反應轉移的電子數為2NA.
,32g甲在足量濃硝酸中反應轉移的電子數為2NA.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com