
分析 (1)實驗室用二氧化錳跟濃鹽酸加熱反應制取氯氣,生成氯化錳、氯氣和水,用高錳酸鉀跟濃鹽酸反應在室溫下制氯氣,在酸性條件下,MnO4-被還原成Mn2+,依據氧化還原反應電子守恒、電荷守恒、原子守恒配平寫出;
(2)用CuCl2作催化劑,在450℃利用空氣中的氧氣跟氯化氫反應制氯氣,生成氯氣和水;
(3)反應中都有元素化合價變化,都屬于氧化還原反應,反應中氯元素化合價都是從-1價變化為0價;
(4)氧化還原反應中氧化劑的氧化性大于氧化產物.
解答 解:(1)實驗室用二氧化錳跟濃鹽酸加熱反應制取氯氣,生成氯化錳、氯氣和水,反應的離子方程式為:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,用高錳酸鉀跟濃鹽酸反應在室溫下制氯氣,在酸性條件下,MnO4-被還原成Mn2+,依據氧化還原反應電子守恒、電荷守恒、原子守恒配平得到化學方程式為:2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O;
故答案為:2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O;
(2)用CuCl2作催化劑,在450℃利用空氣中的氧氣跟氯化氫反應制氯氣,生成氯氣和水,配平書寫化學方程式為:4HCl+O2$\frac{\underline{\;CuCl_{2}\;}}{450℃}$2Cl2↑+2H2O;
故答案為:4HCl+O2$\frac{\underline{\;CuCl_{2}\;}}{450℃}$2Cl2↑+2H2O;
(3)分析三個反應可知都是氯元素化合價升高生成氯氣的反應,所以共同點為:氯元素的化合價從-1升到0價,都屬于氧化還原反應,
故答案為:都屬于氧化還原反應,氯元素的化合價從-1升到0價;
(4)2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,4HCl+O2 $\frac{\underline{\;CuCl_{2}\;}}{450℃}$2Cl2↑+2H2O;
依據氧化還原反應中氧化劑的氧化性大于氧化產物,高錳酸鉀在常溫下氧化濃鹽酸,二氧化錳在加熱條件下氧化濃鹽酸,說明高錳酸鉀氧化性大于二氧化錳,反應化學方程式分析可知二氧化錳的氧化性大于氯氣,氧氣的氧化性大于氯氣;所以氧化性為:KMnO4>MnO2>O2;
故答案為:KMnO4>MnO2>O2.
點評 本題考查了物質性質和化學方程式、離子方程式書寫方法,氧化還原反應規律的應用,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 75% | B. | 25% | C. | 50% | D. | 45% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 都是將負價的氯轉變為零價的氯 | B. | 都是將正價的氯轉變為零價的氯 | ||
| C. | 都是復分解反應 | D. | 都是置換反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
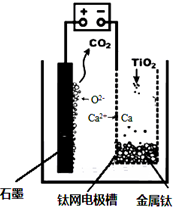 工業上生產金屬鈦的方法很多.以鈦鐵礦(主要成分FeTiO3,鈦酸亞鐵)為主要原料冶煉金屬鈦,生產的工藝流程圖如圖,其中鈦鐵礦與濃硫酸發生反應的化學方程式為:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
工業上生產金屬鈦的方法很多.以鈦鐵礦(主要成分FeTiO3,鈦酸亞鐵)為主要原料冶煉金屬鈦,生產的工藝流程圖如圖,其中鈦鐵礦與濃硫酸發生反應的化學方程式為:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O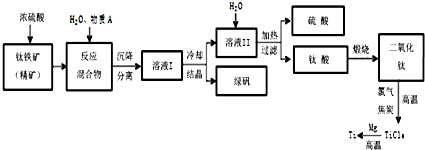
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 電池的總反應式:Cd+2NiOOH+2H2O$?_{充電}^{放電}$2Ni(OH)2+Cd(OH)2 | |
| B. | 電池充電時,鎘元素被還原 | |
| C. | 電池放電時,電池負極周圍溶液的pH不斷增大 | |
| D. | 電池充電時,電池的負極和電源的正極連接 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com