
(13分)
工業上常用鐵質容器盛裝冷濃硫酸。為研究鐵質材料與熱濃硫酸的反應,某學習小組進行了以下探究活動:
【探究一】
(1)將已去除表面氧化物的鐵釘(碳素鋼)放入冷濃硫酸中,10分鐘后移入硫酸銅溶液中,片刻后取出觀察,鐵釘表面無明顯變化,其原因是_____________________
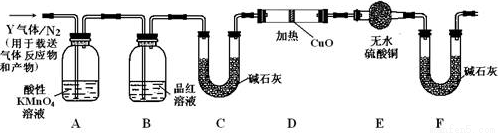
(2)另稱取鐵釘6.0 g放入15.0 mL濃硫酸中,加熱,充分反應后得到溶液X并收集到氣體Y。
①甲同學認為X中除Fe3+外還可能含有Fe2+。若要確認其中的Fe2+應選用___________(選填序號)。
a.KSCN溶液和氯水 b.鐵粉和KSCN溶液 c.濃氨水 d.KMnO4酸性溶液
②乙同學取336 mL(標準狀況)氣體Y通入足量溴水中,發生反應:SO2+Br2+2H2O===2HBr+H2SO4 然后加入足量BaCl2溶液,經__________________操作后得固體2.33 g。由此推知氣體Y中SO2的體積分數為______________。
【探究二】
分析上述實驗中SO2體積分數的結果,丙同學認為氣體Y中還可能含有H2和Q氣體。為此設計了下列探究實驗裝置(圖中夾持儀器省略)。
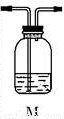
(3)裝置B中試劑的作用是_____________________
(4)認為氣體Y中還含有Q的理由是________________(用化學方程式表示)。
(5)為確認Q的存在,需在裝置中添加M于_________________(選填序號)。
a.A之前 b.A-B間
c.B-C間 d.C-D間
(6)如果氣體Y中含有H2,預計實驗現象應是__________________
(7)若要測定336mL氣體中H2的含量(標準狀況下約有28 mL H2),可否用托盤天平稱量D或E反應前后的質量差的方法?做出判斷并說明理由__________________
科目:高中化學 來源:2015-2016學年廣東省高一上學期9月月考化學試卷(解析版) 題型:選擇題
在標準狀況下,某氣體密度為1.25g/L,則該氣體的相對分子質量為
A.12.5 B.14 C.28 D.30
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山東省臨沂市高二上10月月考化學試卷(解析版) 題型:選擇題
已知反應:2NO2 (g)?N2O4(g),把NO2、N2O4的混合氣體盛裝在兩個連通的燒瓶里,然后用止水夾夾住橡皮管,把燒瓶A放入熱水里,把燒瓶B放入冰水里,如圖所示.與常溫時燒瓶內氣體的顏色進行對比發現,A燒瓶內氣體顏色變深,B燒瓶內氣體顏色變淺.下列說法錯誤的是
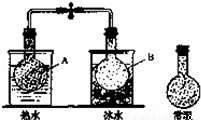
A.上述過程中,A燒瓶內正、逆反應速率均加快
B.上述過程中,B燒瓶內c(NO2)減小,c(N2O4)增大
C.上述過程中,A、B燒瓶內氣體密度均保持不變
D.反應2NO2(g)?N2O4(g)的逆反應為放熱反應
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山西省高二上學期第一次月考化學試卷(解析版) 題型:選擇題
對于可逆反應:2A(g)+B(g)?2C(g)△H<0,下列各圖中正確的是
A.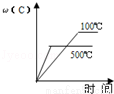 B.
B.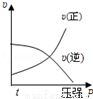
C.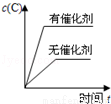 D.
D.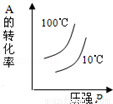
查看答案和解析>>
科目:高中化學 來源:2016屆江蘇省淮安市高三上學期9月月考化學試卷(解析版) 題型:選擇題
根據右圖,下列判斷中正確的是

A.該裝置將電能轉化為化學能
B.Fe電極發生了氧化反應
C.燒杯a中的溶液pH降低
D.燒杯b中發生的反應為Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江省高三上學期10月月考化學試卷(解析版) 題型:選擇題
下列陳述Ⅰ、Ⅱ正確并有因果關系的是
選項 | 陳述Ⅰ | 陳述Ⅱ |
A | 氫氟酸具有酸性 | 氫氟酸可用于雕刻玻璃 |
B | 氯水顯酸性 | 可用pH試紙測氯水的pH |
C | NH3極易溶于水 | NH3可用作制冷劑 |
D | ClO2具有強氧化性 | ClO2可用于自來水的殺菌消毒 |
查看答案和解析>>
科目:高中化學 來源:2016屆湖南省常德市高三上學期10月月考化學試卷(解析版) 題型:選擇題
化學是一門以實驗為基礎的自然科學,化學實驗在化學學習中具有極其重要的作用。下列實驗中所選用的儀器合理的是
①用50mL量筒量取5.2mL稀硫酸
②用分液漏斗分離苯和四氯化碳的混合物
③用托盤天平稱量11.7g氯化鈉晶體
④用堿式滴定管取23.10mL溴水
⑤用瓷坩堝灼燒各種鈉化合物
⑥用250mL容量瓶配制250mL0.2mol/L的NaOH溶液
A.①②④ B.③⑥ C.②③④⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化學 來源:2016屆貴州省興義市高三上學期期中測試理綜化學試卷(解析版) 題型:實驗題
(15分)Ⅰ.乙組同學用下列裝置來證明銅與稀硝酸反應產生一氧化氮,
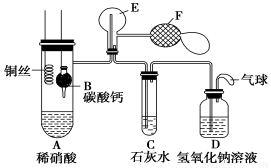
B為一個用金屬絲固定的干燥管,內裝塊狀碳酸鈣固體;E為一個空的蒸餾燒瓶;F是用于鼓入空氣的雙連打氣球。
(1)實驗時,先將B裝置下移,使碳酸鈣與稀硝酸接觸產生氣體,當C處產生白色沉淀時,立刻將B裝置上提,使之與稀硝酸分離。該組學生設計此步操作的目的 。
(2)將A中銅絲放入稀硝酸中,給裝置A微微加熱,在裝置A中產生無色氣體,其反應的離子方程式為________________________。
(3)裝置E中開始時出現淺紅棕色氣體,用F向E中鼓入空氣后,可觀察到燒瓶E內氣體顏色加深,產生上述現象的原因是 。
(4)一段時間后,C中白色沉淀溶解,其原因是____________________。
(5)裝置D的作用是________________________。
Ⅱ.已知向含有淀粉的10mL0.2mol/LKIO3酸性溶液滴滴加0.3mol•L-1NaHSO3溶液的過程中,溶液的顏色先變藍然后褪色,發生的離子反應如下:
①______IO3-+______HSO3-=_______I2+_______SO42-+_______H2O+ ________
②I2+HSO3-+H2O═2I-+SO42-+3H+
回答下列問題
(1)配平離子反應方程式①
______IO3-+______HSO3-=_______I2+_______SO42-+_______H2O+ ________
(2)根據①②反應寫出還原性粒子HSO3-、I2、I-由強到弱的順序_________________;
(3)當溶液剛好褪色時,則消耗的NaHSO3溶液的體積為___________________;
(4)預測已知向含有淀粉的NaHSO3溶液滴加KIO3溶液的現象____________________
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省高二上學期第一次月考化學試卷(解析版) 題型:選擇題

 已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(AgBr)=7.7×10—13,則下列難溶鹽的飽和溶液中, Ag+濃度大小順序正確的是
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(AgBr)=7.7×10—13,則下列難溶鹽的飽和溶液中, Ag+濃度大小順序正確的是
A.AgCl>AgI> AgBr B.AgCl> AgBr>AgI
C.AgBr >AgCl>AgI D.AgBr >AgI>AgCl
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com