
【題目】汽車尾氣中含有CO、NOx等有毒氣體,對汽車加裝尾氣凈化裝置,可使有毒氣體相互反應轉化為無毒氣體。
(1)已知 4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH= -1200kJ·mol-1
4CO2(g)+N2(g) ΔH= -1200kJ·mol-1
①該反應在________________(填“高溫、低溫或任何溫度”)下能自發進行。
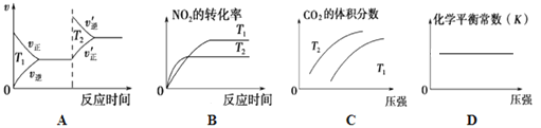
②對于該反應,改變某一反應條件(溫度T1>T2),下列圖像正確的是_______(填序號)。
③某實驗小組模擬上述凈化過程,一定溫度下,在 2L的恒容密閉容器中,起始時按照甲、乙兩種方式進行投料,經過一段時間后達到平衡狀態,測得甲中CO的轉化率為50%,則該反應的平衡常數為__________;兩種方式達平衡時,N2的體積分數:甲______乙( 填“>、=、<或不確定”,下同),NO2的濃度:甲______乙。
甲 | 乙 |
0.2mol NO2 | 0.1mol NO2 |
0.4mol CO | 0.2mol CO |
(2)柴油汽車尾氣中的碳煙(C)和NOx可通過某含鈷催化劑催化消除。不同溫度下,將模擬尾氣(成分如下表所示)以相同的流速通過該催化劑測得所有產物(CO2、N2、N2O)與NO的相關數據結果如圖所示。
模擬尾氣 | 氣體(10mol) | 碳煙 | ||
NO | O2 | He | ||
物質的量(mol) | 0.025 | 0.5 | 9.475 | a |
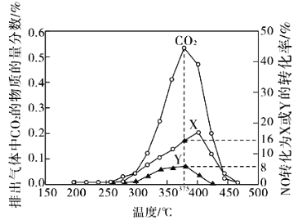
①375℃時,測得排出的氣體中含0.45mol O2和0.0525mol CO2,則Y的化學式為________。
②實驗過程中采用NO模擬NOx,而不采用NO2的原因是______________________。
【答案】低溫 CD 10 > > N2O 2NO2![]() N2O4,NO2氣體中存在N2O4,不便于定量測定。
N2O4,NO2氣體中存在N2O4,不便于定量測定。
【解析】
(1)已知 4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH= -1200 kJ·mol1
4CO2(g)+N2(g) ΔH= -1200 kJ·mol1
① 已知ΔH= -1200 kJ·mol1<0,正反應為氣體體積減小的過程,即為熵減的過程,S<0
結合復合判據ΔH-TS<0反應能自發進行,則該反應在低溫時能自發進行;
②A.已知 T1>T2,由T1 到T2為降溫,反應速率應減小,圖像與實際不符,故A錯誤;
B. 利用“先拐先平數值大”的原則,根據圖中顯示可得T1<T2,圖像與實際不符,故B錯誤;
C.增大壓強反應向體積減小的方向移動,即正反應方向移動,CO2的體積分數增大;保持壓強不變,降低溫度,反應向放熱的方向移動,即正反應方向移動,CO2的體積分數增大,圖像與實際相符合,故C正確;
D. 平衡常數只與溫度有關,改變壓強平衡不移動,圖像與實際相符合,故D正確;
答案選CD;
③設甲中達到平衡狀態時CO的變化量為x mol,則![]() ,可得x=0.2mol,
,可得x=0.2mol,
根據反應4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g),
4CO2(g)+N2(g),
初始(mol)0.4 0.2 0 0
變化(mol)0.2 0.1 0.2 0.05
平衡(mol)0.2 0.1 0.2 0.05
則該反應的平衡常數K=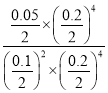 =10
=10
甲的投料時乙的兩倍,條件不變的情況下,兩種方式達平衡時,甲N2的體積分數大于乙,甲NO2的濃度大于乙;
(2)①圖中參與反應生成X和Y的一氧化氮的物質的量為:0.025mol×(8%+16%)=0.006mol,模擬尾氣中O2的物質的量為0.5mol,測得排出的氣體中含0.45mol O2,說明實際參與反應的氧氣的物質的量為0.05mol,同時測得0.0525mol CO2,根據氧原子守恒,可知一氧化二氮的物質的量為:0.05×2+0.0060.0525×2=0.001mol,根據氮原子守恒可知氮氣的物質的量為:![]() ×(0.006-0.001×2)mol=0.002mol,所以16%對應的是氮氣,而8%對應是一氧化二氮,即Y對應是N2O;
×(0.006-0.001×2)mol=0.002mol,所以16%對應的是氮氣,而8%對應是一氧化二氮,即Y對應是N2O;
②實驗過程中采用NO模擬NOx,而不采用NO2的原因是NO2中存在2NO2![]() N2O4的平衡體系,NO2氣體中存在N2O4,不便于定量測定。
N2O4的平衡體系,NO2氣體中存在N2O4,不便于定量測定。


科目:高中化學 來源: 題型:
【題目】納米Fe3O4晶體材料可以作為核磁共振造影增強劑,用于疾病的診斷和治療,其制備過程如圖所示,下列敘述不合理的是
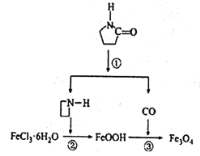
A. 在反應②中,![]() 的作用可能是促進氯化鐵水解
的作用可能是促進氯化鐵水解
B. 直接加熱FeCl3溶液也可以得到Fe3O4
C. 反應③的化學方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
D. 納米四氧化三鐵形成的分散系,有可能產生丁達爾效應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科學家研制出一種催化劑,能在室溫下高效催化空氣中HCHO的氧化,其反應如下:HCHO+O2![]() CO2+H2O。下列有關說法正確的是( )
CO2+H2O。下列有關說法正確的是( )
A. HCHO含有的官能團為羧基
B. CO2分子是由極性鍵形成的極性分子
C. HCHO分子中既含σ鍵又含π鍵
D. 每生成18 g H2O消耗22.4 L O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵鉻氧化還原液流電池是一種低成本的儲能電池,電池結構如圖所示,工作原理為Fe3++Cr2+![]() Fe2++Cr3+。下列說法正確的是( )
Fe2++Cr3+。下列說法正確的是( )
![]()
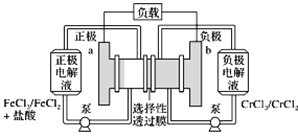
A. 電池放電時,a極的電極反應式為Fe3++3e===Fe
B. 電池放電時,電路中每通過0.1 mol電子,Fe3+濃度降低0.1 mol·L1
C. 電池充電時,Cl從a極穿過選擇性透過膜移向b極
D. 電池充電時,b極的電極反應式為Cr3++e===Cr2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向偏鋁酸鈉溶液中逐滴加入鹽酸,溶液的pH值隨著加入鹽酸體積的變化曲線如圖所示,則下列說法正確的是
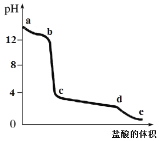
A.a~b段的主要離子方程式為A1O2+4H+=Al3++2H2O
B.向c點溶液中滴加氨水,發生的離子方程式為 A13++3OH=Al(OH)3↓
C.c~d段的主要離子方程式為Al(OH)3+3H+=A13++3H2O
D.向c點溶液中加入碳酸鈉,發生的離子方程式為2A13++3CO32+3H2O=2Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,容器內某一反應種M、N的物質的量隨反應時間變化的曲線如下圖,下列表述中正確的是
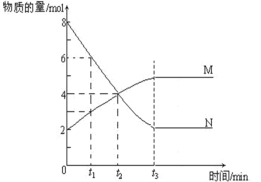
A.t2時,正逆反應速率相等,達到平衡
B.t3時間以后,正反應速率大于逆反應速率
C.t1時N的濃度是M的兩倍
D.達到平衡時,N的濃度與M的濃度相等且不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列對化學平衡移動的分析中,不正確的是
①已達平衡的反應C(s)+H2O(g)![]() CO(g)+H2(g),當增加反應物物質的量時,平衡一定向正反應方向移動 ②已達平衡的反應N2(g)+3H2(g)
CO(g)+H2(g),當增加反應物物質的量時,平衡一定向正反應方向移動 ②已達平衡的反應N2(g)+3H2(g)![]() 2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率一定升高 ③有氣體參加的反應達到平衡時,若減小反應器容積時,平衡一定向氣體體積增大的方向移動 ④有氣體參加的反應達平衡時,在恒壓反應器中充入稀有氣體,平衡一定不移動
2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率一定升高 ③有氣體參加的反應達到平衡時,若減小反應器容積時,平衡一定向氣體體積增大的方向移動 ④有氣體參加的反應達平衡時,在恒壓反應器中充入稀有氣體,平衡一定不移動
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,除標出的元素外,表中的每個編號表示一種元素,請根據要求回答下列問題。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | |||||
3 | ③ | ④ | ⑤ | ⑥ |
(1)①和②兩種元素的非金屬性強弱關系是:①________②(填“>”或“<”)。
(2)③和⑥兩種元素形成的化合物中含有的化學鍵為__________(填“離子鍵”或“共價鍵”) 。
(3)元素②和⑤組成的化合物屬于_________(填“酸性”“堿性”或“兩性”)氧化物。
(4)工業上冶煉元素④所形成的單質,其相關反應的化學方程式為_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質:(用序號填空)
① O2和O3 ; ②12C 與14C; ③ CH3 (CH2) 3 CH3和![]()
④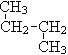 和
和![]() ;
;
(1)互為同位素的是_______ ;(2)互為同素異形體的是________;
(3)互為同分異構體的是________;(4)屬于同一物質的是________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com