
【題目】納米Fe3O4晶體材料可以作為核磁共振造影增強劑,用于疾病的診斷和治療,其制備過程如圖所示,下列敘述不合理的是
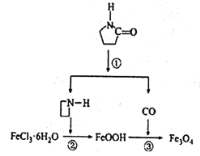
A. 在反應②中,![]() 的作用可能是促進氯化鐵水解
的作用可能是促進氯化鐵水解
B. 直接加熱FeCl3溶液也可以得到Fe3O4
C. 反應③的化學方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
D. 納米四氧化三鐵形成的分散系,有可能產生丁達爾效應
 高中必刷題系列答案
高中必刷題系列答案科目:高中化學 來源: 題型:
【題目】某溶液中只可能含有下列離子中的幾種:K+、NO![]() 、SO
、SO![]() 、NH
、NH![]() 、CO
、CO![]() (不考慮溶液中少量的H+和OH-),取200mL該溶液,分為兩等份進行下列實驗:
(不考慮溶液中少量的H+和OH-),取200mL該溶液,分為兩等份進行下列實驗:
實驗1:第一份加入足量的燒堿并加熱,產生的氣體在標準狀況下為224mL;(已知NH4+在堿性條件下可以生產氨氣)
實驗2:第二份先加入足量的鹽酸,無現象,再加入足量的BaCl2溶液,得固體2.33g。
下列說法正確的是( )
A. 該溶液中無法確定是否含有K+
B. 該溶液中肯定含有NO![]() 、SO
、SO![]() 、NH
、NH![]() 、CO
、CO![]()
C. 不能確定該溶液中是否含有NO![]()
D. 該溶液中一定含K+,且c(K+)= 0.1mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實能用勒夏特列原理解釋的是
A. 工業制硫酸采用二氧化硫催化氧化,高溫可以提高單位時間SO3的產量
B. 合成氨工業中使用鐵觸媒做催化劑
C. 用飽和食鹽水除去氯氣中氯化氫雜質
D. 容器中有2HI(g)![]() H2(g)+I2(g),增大壓強顏色變深
H2(g)+I2(g),增大壓強顏色變深
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】AG均分別代表一種物質,結合如圖所示的轉化關系(框圖中的部分產物已略去),回答下列問題:

已知:I.天然有機高分子化合物A,是一種遇到碘水能變藍的多糖;
Ⅱ. H為丙三醇(CH2OH-CHOH-CH2OH),G有香味。
(1)①C→E的反應類型為_________。
②與出D→C的化學反應方程式:_________。
③寫出F與H以物質的量3:1濃硫酸、加熱條件下發生的化學方程式:_____。
(2)人在劇列運動后腿和胳膊會感到酸脹或疼痛,原因之一是B(C6H12O6)→2C3H6O3(乳酸)。某研究小組為了研究乳酸(無色液體,與水混溶)的性質,做了如下實驗:
①取90g乳酸飽和NaHCO3溶液反應,測得生成的氣體體積為22.4L(標準狀況下);
②另取90g乳酚與過量的金屬鈉反應,測得生成的氣體體積為22.4L(標準狀況下)。
由以上實驗推知乳酸分子含有的官能團名稱________;試寫出所有符合上述條件有機物的同分異構體的結構簡式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】500oC下,在2L體積固定的密閉容器中發生反應:2A(g)![]() 2B(g)+C(g)若開始時只充入2molA氣體,達平衡時,混合氣體的總物質的量為2.4mol。(作答此題時,要求寫出計算過程)
2B(g)+C(g)若開始時只充入2molA氣體,達平衡時,混合氣體的總物質的量為2.4mol。(作答此題時,要求寫出計算過程)
(1)計算500oC時該反應的化學平衡常數?
(2)平衡時A的轉化率是多少?
(3)設溫度不變,反應前容器內壓強為p0,則反應達平衡時,容器內壓強是多少?(用p0表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在三個容積相同的恒容密閉容器中按不同的方式投入反應物,發生反應 N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol,測得反應的相關數據如下表:
2NH3(g) △H=-92.4kJ/mol,測得反應的相關數據如下表:
容器甲 | 容器乙 | 容器丙 | |
反應溫度/℃ | 400 | 400 | 500 |
反應物投入量 | 1molN2,3molH2 | 4molNH3 | 1molN2,3molH2 |
平衡時v(正)(H2)/mol/(Ls) | v1 | v2 | v3 |
平衡時c(NH3)/(mol/L) | c1 | c2 | c3 |
平衡時總壓強P/Pa | P1 | P2 | P3 |
物質的平衡轉化率a | a1(N2) | a2(NH3) | a3(N2) |
平衡常數K | K1 | K2 | K3 |
下列關系正確的是
A. v1<v2,c1<2c2 B. c2>2c3,a2(NH3)+a3(N2)<1
C. K1>K3, P2>2P3 D. v1<v3,a1(N2)<a3(N2)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銀的冶煉有很多方法,在《天工開物》均有記載,而現代流行的“氰化法”,即 用NaCN溶液浸出礦石中的銀的方法是常用的方法。該方法具備諸多優點:銀的回收率高、對游離態和化合態的銀均能浸出、對能源消耗相對較少,生產工藝簡便等,但銀化物通常有毒。其煉制工藝簡介如下:
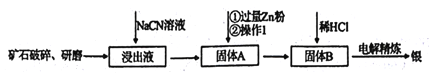
(1)礦石需要先進行破碎、研磨,其目的是_________。
(2)寫出該工藝的一個明顯的缺點____________。
(3)用NaCN浸泡礦石(該礦石是輝銀礦,其主要成分是Ag2S)時,反應容器處于開口狀態,產生的銀以[Ag(CN)2]-形式存在,硫元素被氧化至最高價,試寫出主要反應的離子方程式________。
(4)銀往往和鋅、銅、金等礦伴生,故氰化法得到的銀中往往因含有上述金屬而不純凈,需要進一步純化,從而獲得純凈的銀。其中方法之一就是進行電解精煉,在精煉過程中,含有雜質的銀作_______極(填“陰”或“陽”),該電極上發生的主要反應式為_____。
(5)有人提出了另外的提純銀的方案,先將鋅粉還原后的混合金屬用略過量的硝酸溶解,通 過精確調整溶液的pH來進行金屬元素逐一分離,已知:
①溶解后的離子濃度如表:
Zn2+ | Cu2+ | Ag+ | |
物質的量濃度(mol/L) | 0.001 | 0.002 | 0.5 |
②某些金屬離子的氫氧化物Ksp如表:
Zn2+ | Cu2+ | Ag+ | …… | |
Ksp | 1.0×10-17 | 2.0×10-20 | 2.0×10-8 |
(已知lg2=0.3),該設計方案 ______(填“可行”或“不可行”),其原因是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硒及其化合物在生產、生活中有著廣泛的應用,摻雜硒的納米氧化亞銅常用作光敏材料、電解錳行業催化劑等。
(1)酸性溶液中Na2SO3將H2SeO3和H2SeO4還原為曬單質的反應如下:
H2SeO3(aq)+2SO2(g)+H2O(l)=Se(s)+2H2SO4(aq) △H1
2H2SeO4(aq)+Se(s)+H2O(l)=3H2SO4(aq) △H2
H2SeO4(aq)+2SO2(g)+2H2O(l)=Se(s)+3H2SO4(aq) △H3
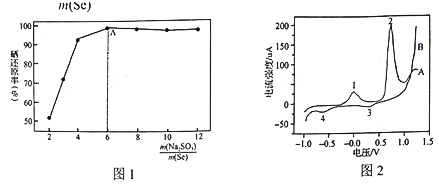
實驗中控制其他條件不變(鹽酸濃度等),![]() 與硒還原率關系如圖1。在A點之前,隨著
與硒還原率關系如圖1。在A點之前,隨著![]() 的增加,Se的還原率不斷升高的原因是_____________。
的增加,Se的還原率不斷升高的原因是_____________。
(2)向Na2SeO3溶液中加入適量的AgNO3溶液,得到Ag2Se納米晶體,同時產生N2。該反應的離子方程式為 ______。
(3)制 PbSe 納米管時還產生了副產物PbSeO3。己知:Ksp(PbSeO3)=3×l0-12, Ksp(PbSe)= 3×l0-38。為了除去PbSe中混有的PbSeO3,可以采取的措施是______。
(4)實驗室測得堿性條件下PbSe納米管在電極表面的氧化還原行為,結果如圖2所示。其中一條曲線上的峰表示氧化過程,另一條曲線上的峰表示還原過程。整個過程共發生如下變化:Pb(OH)2—PbO2;Pb(OH)2—Pb; PbSe—Se; PbO2→Pb(OH)2,各物質均難溶于水。峰1對應的電極反應式為:PbSe-2e-+2OH-=Pb(OH)2+Se;則峰2對應的電極反應式為 ______。
(5)摻雜硒的納米Cu2O催化劑可用于工業上合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H=akJ/mol。按n(H2):n(CO)=1:1的投料比將H2與CO充入VL的恒容密閉容器中,在一定條件下發生反應,測得CO的平衡轉化率與溫度、壓強的關系如下圖所示。
CH3OH(g) △H=akJ/mol。按n(H2):n(CO)=1:1的投料比將H2與CO充入VL的恒容密閉容器中,在一定條件下發生反應,測得CO的平衡轉化率與溫度、壓強的關系如下圖所示。
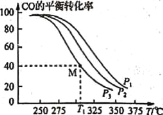
①壓強P1、P2、P3由小到大的順序是 __________。
②T1 ℃時若向該容器中充入2.0 mol H2和2.0 mol CO發生上述反應,5 min后反應達到平衡(M點),則M點對應條件下反應的平衡常數為 ______。
(6)將CuCl水解再熱分解可得到納米Cu2O。CuCl 水解的反應為 CuCl(s) +H2O(1) ![]() CuOH(s)+Cl-(aq)+H+(aq),該反應的平衡常數 K與此溫度下Kw、Ksp(CuOH)、Ksp(CuCl)的關系為K=________。
CuOH(s)+Cl-(aq)+H+(aq),該反應的平衡常數 K與此溫度下Kw、Ksp(CuOH)、Ksp(CuCl)的關系為K=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用50 mL 0.50 mol/L的鹽酸與50 mL 0.55 mol/L的氫氧化鈉溶液在如圖所示的裝置中進行中和反應,通過測定反應過程中所放出的熱量可計算中和熱。回答下列問題:

(1)燒杯間填滿碎泡沫塑料的作用是___________________________
(2)環形玻璃攪拌棒能否用環形鐵質攪拌棒代替?_______(填“能”或“不能”), 其原因是____________________________。
(3)實驗時氫氧化鈉溶液的濃度要用0.55 mol/L的原因是___________________________。
實驗中若改用60 mL 0.50 mol/L的鹽酸與50 mL 0.55 mol/L的氫氧化鈉溶液進行反應, 與上述實驗相比,所放出的熱量________________(填“相等”“不相等”),若實驗操作均正確,則所求中和熱_________(填“相等”“不相等”)。
(4)已知在稀溶液中,強酸和強堿發生中和反應生成1 mol H2O時,放出57.3 kJ的熱量,則上述反應的熱化學方程式為:___________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com