
分析 兩種可能:一是發生氧化還原反應:2Fe3++SO32-+H2O═2Fe2++SO42-+2H+;二是發生雙水解反應:2Fe3++3SO32-+3H2O=2Fe(OH)3↓+3SO2↑.
實驗I:觀察到無氣泡產生,無沉淀生成,但溶液顏色最終變為紅褐色,可知生成氫氧化鐵膠體,加鹽酸時先聚沉后溶解;
將所得溶液加入BaCl2稀溶液,有少量白色沉淀生成,白色沉淀為硫酸鋇;
實驗Ⅱ:現象相同,可知都生成膠體,都有硫酸鋇生成;
綜上所述,氧化還原反應與相互促進水解反應均發生,藥品中亞硫酸鈉可能變質混有硫酸鈉,以此來解答.
解答 解:兩種可能:一是發生氧化還原反應:2Fe3++SO32-+H2O═2Fe2++SO42-+2H+;二是發生雙水解反應:2Fe3++3SO32-+3H2O=2Fe(OH)3↓+3SO2↑.
實驗I:觀察到無氣泡產生,無沉淀生成,但溶液顏色最終變為紅褐色,可知生成氫氧化鐵膠體,加鹽酸時先聚沉后溶解,這種紅褐色液體是Fe(OH)3膠體;
將所得溶液加入BaCl2稀溶液,有少量白色沉淀生成,白色沉淀為硫酸鋇,發生的離子反應為;
實驗Ⅱ:現象相同,可知都生成膠體,都有硫酸鋇生成;
綜上所述,Fe3+和SO32-在溶液中既發生氧化還原反應,又發生互促水解反應;
該設計有缺陷,應在開始實驗前對某主要藥品進行檢驗,該主要藥品為Na2SO3溶液;檢驗的目的是,
故答案為:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;2Fe3++3SO32-+3H2O=2Fe(OH)3↓+3SO2↑;③Fe(OH)3膠體;Ba2++SO42-=BaSO4↓;Fe3+和SO32-在溶液中既發生氧化還原反應,又發生互促水解反應;Na2SO3溶液;判斷反應前Na2SO3溶液是否已經部分被氧化.
點評 本題考查性質實驗方案的設計,為高頻考點,把握物質的性質、發生的反應為解答該題的關鍵,側重分析和實驗能力的考查,注意氧化還原反應及水解原理的應用,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 任何酸與堿反應生成1 mol H2O的過程中,放出的熱量均相同 | |
| B. | 等量的硫蒸氣和硫固體分別完全燃燒,前者放出熱量多 | |
| C. | 光照時,H2(g)+Cl2(g)═2HCl(g)△H=aKJ/mol;若反應條件變為點燃,△H將減少 | |
| D. | 表示碳燃燒熱的熱化學方程式為:2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
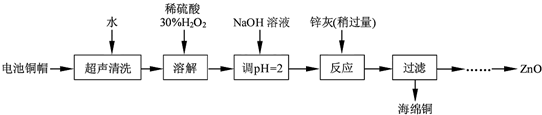
| 開始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
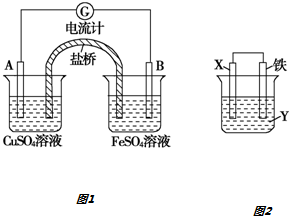
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯使溴水褪色 | B. | 乙醇與濃硫酸共熱至170℃ | ||
| C. | 溴乙烷與NaOH水溶液共熱 | D. | 在液溴與苯的混合物中撒入鐵粉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
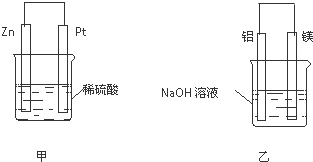
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com