
| A. | 活化分子間所發生的碰撞都為有效碰撞 | |
| B. | 合成氨工業中用鐵觸媒做催化劑能用勒夏特列原理解釋 | |
| C. | 升高溫度能使化學反應速率增大的主要原因是增加了單位體積內活化分子的百分數 | |
| D. | 將鋼閘門與電源的正極相連,是采用了外加電流的陰極保護法 |
分析 A.活化分子間所發生的分子間的碰撞,只有能發生反應的碰撞才是有效碰撞;
B.勒夏特利原理適用的對象應存在可逆過程,如與可逆過程的平衡移動無關、與平衡移動無關,則不能用勒夏特利原理解釋;
C.升高溫度,活化分子百分數增加,化學反應速率增大;
D.采用外加電流的陰極保護法保護金屬時,被保護的金屬作陰極.
解答 解:A.活化分子間所發生的分子間的碰撞,只有能發生反應的碰撞才是有效碰撞,故A錯誤;
B.催化劑只是影響反應速率,不能用勒夏特列原理解釋,故B錯誤;
C.升高溫度,增加了單位體積內活化分子百分數,化學反應速率一定能夠增大,故C正確;
D.采用外加電流的陰極保護法保護金屬時,被保護的金屬作陰極,所以鋼閘門與電源的負極相連,故D錯誤;
故選C.
點評 本題考查學生影響化學反應速率的因素中的溫度、濃度因素、電解池原理的分析應用,可以根據所學知識進行回答,難度不大.


 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:高中化學 來源: 題型:多選題
| A. | 常溫下,0.1 mol•L-1 HA溶液的pH=3,則HA的電離:HA=H++A- | |
| B. | 用銅電極電解飽和硫酸銅溶液:2Cu2++2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 向1 mL 2 mol•L-1NaOH溶液中滴加1~2滴0.1 mol•L-1MgCl2溶液后,再滴加2滴0.1 mol•L-1 FeCl3溶液:Mg2++2OH-═Mg(OH)2↓,3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 鋼鐵發生吸氧腐蝕生成鐵銹:2Fe+O2+2H2O═2Fe(OH)2,4Fe(OH)2+O2+2H2O═4Fe(OH)3,2Fe(OH)3═Fe2O3•xH2O+(3-x)H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 |
| 沉淀物 | CuS | ZnS | MnS | FeS | ||
| Ksp | 8.5×10-45 | 1.2×10-23 | 1.4×10-15 | 3.7×10-14 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
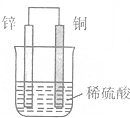
| A. | 鋅片上有H2逸出 | B. | 溶液中c(H+)逐漸減小 | ||
| C. | 正極反應式:2H++2e-═H2↑ | D. | 負極反應式:Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在空氣中燃燒時,硫的燃燒熱小,使化學平衡向有利于生成SO3的方向移動 | |
| B. | 在純氧氣中燃燒時,硫的燃燒熱大,不利于化學平衡向生成SO3的方向移動 | |
| C. | 在硫燃燒的過程中,對于SO3的生成,溫度的影響大于氧氣濃度的影響 | |
| D. | 沒有使用催化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在相同條件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 還原性:I->Br->Cl->F- | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸氫鈉溶液與稀鹽酸互滴時兩種操作現象相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,反應4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自發進行,則△H<0 | |
| B. | 鐵片鍍鋅時,鐵片與外電源的正極相連 | |
| C. | 以熔融NaCl為電解質進行電解冶煉鈉,熔融體中Na+向陽極移動 | |
| D. | t℃時,恒容密閉容器中反應:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO)•c(S{O}_{3})}{c(N{O}_{2})•c(S{O}_{2})}$的值及SO2轉化率不變 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com