

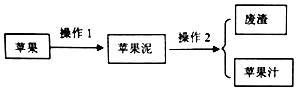
分析 該實驗原理是:根據黃銅礦受熱分解產生的二氧化硫的量的測定(二氧化硫可以用碘水來標定),結合元素守恒可以確定黃銅礦的量,進而計算其純度,
(1)依據化學方程式中元素化合價變化分析,元素化合價升高的得到氧化產物,
(2)研磨固體要在研缽中進行,裝置c中灼熱的銅網能與空氣中的氧氣反應,吸收未反應的氧氣;
(3)d中溶液中溶解有二氧化硫,用標準碘溶液滴定d中溶液,碘與二氧化硫反應生成硫酸根離子和碘離子;用淀粉作指示劑時,滴定達終點時溶液出現藍色;
(4)為了使生成的二氧化硫被充分吸收,結束后仍需通一段時間的空氣;
(5)二氧化硫和單質碘之間發生氧化還原反應,根據消耗碘單質的量可以確定二氧化硫的量,進而確定黃銅礦的純度;
(6)二氧化碳和二氧化硫均可以和氫氧化鋇反應生成白色沉淀,亞硫酸鋇易被氧化為硫酸鋇,據此分析;
解答 解:該實驗原理是:根據黃銅礦受熱分解產生的二氧化硫的量的測定(二氧化硫可以用碘水來標定),結合元素守恒可以確定黃銅礦的量,進而計算其純度,
(1)根據反應3CuFeS2+8O2$\frac{\underline{\;高溫\;}}{\;}$ 3Cu+Fe3O4+6SO2,反應鐵元素從+2價變為+3價,硫從-2價變為+4價,所以反應中氧化產物為Fe3O4、SO2,
故答案為:Fe3O4、SO2;
(2)研磨固體要在研缽中進行,裝置c中灼熱的銅網能與空氣中的氧氣反應,吸收未反應的氧氣,
故答案為:研缽;除去反應多余的氧氣;
(3)d中溶液中溶解有二氧化硫,用標準碘溶液滴定d中溶液,碘與二氧化硫反應生成硫酸根離子和碘離子,反應的離子方程式為I2+SO2+2H2O=4H++SO42-+2I-,用淀粉作指示劑時,滴定達終點時溶液由無色變為藍色且保持30s不變,
故答案為:I2+SO2+2H2O=4H++SO42-+2I-;溶液由無色變為藍色且保持30s不變;
(4)黃銅礦受熱分解生成二氧化硫等一系列產物,分解完畢后仍然通入空氣,可以將產生的二氧化硫全部排出去,使結果精確,
故答案為:使反應生成的SO2全部進入d裝置中,使結果精確;
(5)根據反應實質,得到:2I2~2SO2~CuFeS2,消耗掉0.05mol/L標準碘溶液20.00mL時,即消耗的碘單質的量為:0.05mol/L×0.02L=0.0010mol,所以黃銅礦的質量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其純度是:$\frac{0.92g}{1.84g}$×100%=50%,故答案為:50%;
(6)空氣中的CO2與Ba(OH)2反應可以生成BaCO3沉淀,此外BaSO3被氧化成BaSO4均可以導致所以的沉淀的量比二氧化硫和氫氧化鋇反應生成的白色沉淀的量多,
故答案為:空氣中的CO2與Ba(OH)2反應生成BaCO3沉淀,BaSO3被氧化成BaSO4.
點評 本題考查了探究黃銅礦的純度,涉及了儀器選擇、純度計算等知識,題量較大,充分考查了學生分析和解決問題的能力,本題難度較大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | $\frac{2c}{b-a}$ | B. | $\frac{b}{2(c-a)}$ | C. | $\frac{c-a}{b-a}$ | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 每生成2molAB吸收b kJ熱量 | |
| B. | 該反應熱△H=(b-a)kJ•mol-1 | |
| C. | 該反應為吸熱反應 | |
| D. | 斷裂1 mol A-A和1 mol B-B鍵放出a kJ能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
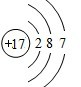 ,C元素離子電子式Na+.
,C元素離子電子式Na+. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某無色溶液可大量存在:H+、Cl-、MnO4- | |
| B. | 水電離的c(H+)=1×10-13mol/L的溶液中可能存在:K+、Na+、[Al(OH)4]-、CO32- | |
| C. | 與Al反應能放出H2的溶液中可大量存在:Fe2+、K+、NO3-、SO42- | |
| D. | 氫氧化鈣溶液中可大量存在:Na+、ClO-、HCO3- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com